+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0780 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | cryo-EM structure of human PA200 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Proteasome activator / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報spermatoproteasome complex / sperm DNA condensation / Proteasome assembly / : / peptidase activator activity / proteasomal ubiquitin-independent protein catabolic process / proteasome binding / nuclear speck / DNA repair / DNA damage response ...spermatoproteasome complex / sperm DNA condensation / Proteasome assembly / : / peptidase activator activity / proteasomal ubiquitin-independent protein catabolic process / proteasome binding / nuclear speck / DNA repair / DNA damage response / nucleoplasm / nucleus / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.75 Å | |||||||||
 データ登録者 データ登録者 | Ouyang S / Hongxin G | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: PLoS Biol / 年: 2020 ジャーナル: PLoS Biol / 年: 2020タイトル: Cryo-EM structures of the human PA200 and PA200-20S complex reveal regulation of proteasome gate opening and two PA200 apertures. 著者: Hongxin Guan / Youwang Wang / Ting Yu / Yini Huang / Mianhuan Li / Abdullah F U H Saeed / Vanja Perčulija / Daliang Li / Jia Xiao / Dongmei Wang / Ping Zhu / Songying Ouyang /  要旨: Proteasomes are highly abundant and conserved protease complexes that eliminate unwanted proteins in the cells. As a single-chain ATP-independent nuclear proteasome activator, proteasome activator ...Proteasomes are highly abundant and conserved protease complexes that eliminate unwanted proteins in the cells. As a single-chain ATP-independent nuclear proteasome activator, proteasome activator 200 (PA200) associates with 20S core particle to form proteasome complex that catalyzes polyubiquitin-independent degradation of acetylated histones, thus playing a pivotal role in DNA repair and spermatogenesis. Here, we present cryo-electron microscopy (cryo-EM) structures of the human PA200-20S complex and PA200 at 2.72 Å and 3.75 Å, respectively. PA200 exhibits a dome-like architecture that caps 20S and uses its C-terminal YYA (Tyr-Tyr-Ala) to induce the α-ring rearrangements and partial opening of the 20S gate. Our structural data also indicate that PA200 has two openings formed by numerous positively charged residues that respectively bind (5,6)-bisdiphosphoinositol tetrakisphosphate (5,6[PP]2-InsP4) and inositol hexakisphosphate (InsP6) and are likely to be the gates that lead unfolded proteins through PA200 and into the 20S. Besides, our structural analysis of PA200 found that the bromodomain (BRD)-like (BRDL) domain of PA200 shows considerable sequence variation in comparison to other human BRDs, as it contains only 82 residues because of a short ZA loop, and cannot be classified into any of the eight typical human BRD families. Taken together, the results obtained from this study provide important insights into human PA200-induced 20S gate opening for substrate degradation and the opportunities to explore the mechanism for its recognition of H4 histone in acetylation-mediated proteasomal degradation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0780.map.gz emd_0780.map.gz | 28.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0780-v30.xml emd-0780-v30.xml emd-0780.xml emd-0780.xml | 11.5 KB 11.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0780_fsc.xml emd_0780_fsc.xml | 7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0780.png emd_0780.png | 35.6 KB | ||
| Filedesc metadata |  emd-0780.cif.gz emd-0780.cif.gz | 6.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0780 http://ftp.pdbj.org/pub/emdb/structures/EMD-0780 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0780 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0780 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0780.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0780.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : human PA200
| 全体 | 名称: human PA200 |
|---|---|
| 要素 |
|
-超分子 #1: human PA200
| 超分子 | 名称: human PA200 / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Proteasome activator complex subunit 4
| 分子 | 名称: Proteasome activator complex subunit 4 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 215.774875 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGTTRSTMSY YHHHHHHDYD IPTTENLYFQ GAMDPMEPAE RAGVGEPPEP GGRPEPGPRG FVPQKEIVYN KLLPYAERLD AESDLQLAQ IKCNLGRAVQ LQELWPGGLF WTRKLSTYIR LYGRKFSKED HVLFIKLLYE LVSIPKLEIS MMQGFARLLI N LLKKKELL ...文字列: MGTTRSTMSY YHHHHHHDYD IPTTENLYFQ GAMDPMEPAE RAGVGEPPEP GGRPEPGPRG FVPQKEIVYN KLLPYAERLD AESDLQLAQ IKCNLGRAVQ LQELWPGGLF WTRKLSTYIR LYGRKFSKED HVLFIKLLYE LVSIPKLEIS MMQGFARLLI N LLKKKELL SRADLELPWR PLYDMVERIL YSKTEHLGLN WFPNSVENIL KTLVKSCRPY FPADATAEML EEWRPLMCPF DV TMQKAIT YFEIFLPTSL PPELHHKGFK LWFDELIGLW VSVQNLPQWE GQLVNLFARL ATDNIGYIDW DPYVPKIFTR ILR SLNLPV GSSQVLVPRF LTNAYDIGHA VIWITAMMGG PSKLVQKHLA GLFNSITSFY HPSNNGRWLN KLMKLLQRLP NSVV RRLHR ERYKKPSWLT PVPDSHKLTD QDVTDFVQCI IQPVLLAMFS KTGSLEAAQA LQNLALMRPE LVIPPVLERT YPALE TLTE PHQLTATLSC VIGVARSLVS GGRWFPEGPT HMLPLLMRAL PGVDPNDFSK CMITFQFIAT FSTLVPLVDC SSVLQE RND LTEVERELCS ATAEFEDFVL QFMDRCFGLI ESSTLEQTRE ETETEKMTHL ESLVELGLSS TFSTILTQCS KEIFMVA LQ KVFNFSTSHI FETRVAGRMV ADMCRAAVKC CPEESLKLFV PHCCSVITQL TMNDDVLNDE ELDKELLWNL QLLSEITR V DGRKLLLYRE QLVKILQRTL HLTCKQGYTL SCNLLHHLLR STTLIYPTEY CSVPGGFDKP PSEYFPIKDW GKPGDLWNL GIQWHVPSSE EVSFAFYLLD SFLQPELVKL QHCGDGKLEM SRDDILQSLT IVHNCILGSG NLLPPLKGEP VTNLVPSMVS LEETKLYTG LEYDLSRENH REVIATVIRK LLNHILDNSE DDTKSLFLII KIIGDLLQFQ GSHKHEFDSR WKSFNLVKKS M ENRLHGKK QHIRALLIDR VMLQHELRTL TVEGCEYKKI HQDMIRDLLR LSTSSYSQVR NKAQQTFFAA LGAYNFCCRD II PLVLEFL RPDRQGVTQQ QFKGALYCLL GNHSGVCLAN LHDWDCIVQT WPAIVSSGLS QAMSLEKPSI VRLFDDLAEK IHR QYETIG LDFTIPKSCV EIAELLQQSK NPSINQILLS PEKIKEGIKR QQEKNADALR NYENLVDTLL DGVEQRNLPW KFEH IGIGL LSLLLRDDRV LPLRAIRFFV ENLNHDAIVV RKMAISAVAG ILKQLKRTHK KLTINPCEIS GCPKPTQIIA GDRPD NHWL HYDSKTIPRT KKEWESSCFV EKTHWGYYTW PKNMVVYAGV EEQPKLGRSR EDMTEAEQII FDHFSDPKFV EQLITF LSL EDRKGKDKFN PRRFCLFKGI FRNFDDAFLP VLKPHLEHLV ADSHESTQRC VAEIIAGLIR GSKHWTFEKV EKLWELL CP LLRTALSNIT VETYNDWGAC IATSCESRDP RKLHWLFELL LESPLSGEGG SFVDACRLYV LQGGLAQQEW RVPELLHR L LKYLEPKLTQ VYKNVRERIG SVLTYIFMID VSLPNTTPTI SPHVPEFTAR ILEKLKPLMD VDEEIQNHVM EENGIGEED ERTQGIKLLK TILKWLMASA GRSFSTAVTE QLQLLPLFFK IAPVENDNSY DELKRDAKLC LSLMSQGLLY PHQVPLVLQV LKQTARSSS WHARYTVLTY LQTMVFYNLF IFLNNEDAVK DIRWLVISLL EDEQLEVREM AATTLSGLLQ CNFLTMDSPM Q IHFEQLCK TKLPKKRKRD PGSVGDTIPS AELVKRHAGV LGLGACVLSS PYDVPTWMPQ LLMNLSAHLN DPQPIEMTVK KT LSNFRRT HHDNWQEHKQ QFTDDQLLVL TDLLVSPCYY A UniProtKB: Proteasome activator complex subunit 4 |
-分子 #2: [(1~{S},2~{R},3~{R},4~{S},5~{S},6~{R})-2-[oxidanyl(phosphonooxy)p...
| 分子 | 名称: [(1~{S},2~{R},3~{R},4~{S},5~{S},6~{R})-2-[oxidanyl(phosphonooxy)phosphoryl]oxy-3,4,5,6-tetraphosphonooxy-cyclohexyl] phosphono hydrogen phosphate タイプ: ligand / ID: 2 / コピー数: 1 / 式: K0W |
|---|---|
| 分子量 | 理論値: 819.995 Da |
| Chemical component information | 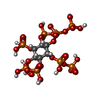 ChemComp-K0W: |
-分子 #3: INOSITOL HEXAKISPHOSPHATE
| 分子 | 名称: INOSITOL HEXAKISPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: IHP |
|---|---|
| 分子量 | 理論値: 660.035 Da |
| Chemical component information |  ChemComp-IHP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















