+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20867 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the Escherichia coli McrBC complex | |||||||||
 マップデータ マップデータ | FL-EcMcrBC | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Endonuclease / AAA protein / GTPase / Methylation-dependent restriction / DNA BINDING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報type IV site-specific deoxyribonuclease activity / restriction endodeoxyribonuclease activity / endonuclease complex / double-stranded methylated DNA binding / hemi-methylated DNA-binding / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / DNA catabolic process / DNA restriction-modification system / endonuclease activity / GTPase activity ...type IV site-specific deoxyribonuclease activity / restriction endodeoxyribonuclease activity / endonuclease complex / double-stranded methylated DNA binding / hemi-methylated DNA-binding / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / DNA catabolic process / DNA restriction-modification system / endonuclease activity / GTPase activity / GTP binding / ATP hydrolysis activity / DNA binding / ATP binding / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.28 Å | |||||||||
 データ登録者 データ登録者 | Niu Y / Suzuki H | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Structural asymmetry governs the assembly and GTPase activity of McrBC restriction complexes. 著者: Yiming Niu / Hiroshi Suzuki / Christopher J Hosford / Thomas Walz / Joshua S Chappie /   要旨: McrBC complexes are motor-driven nucleases functioning in bacterial self-defense by cleaving foreign DNA. The GTP-specific AAA + protein McrB powers translocation along DNA and its hydrolysis ...McrBC complexes are motor-driven nucleases functioning in bacterial self-defense by cleaving foreign DNA. The GTP-specific AAA + protein McrB powers translocation along DNA and its hydrolysis activity is stimulated by its partner nuclease McrC. Here, we report cryo-EM structures of Thermococcus gammatolerans McrB and McrBC, and E. coli McrBC. The McrB hexamers, containing the necessary catalytic machinery for basal GTP hydrolysis, are intrinsically asymmetric. This asymmetry directs McrC binding so that it engages a single active site, where it then uses an arginine/lysine-mediated hydrogen-bonding network to reposition the asparagine in the McrB signature motif for optimal catalytic function. While the two McrBC complexes use different DNA-binding domains, these contribute to the same general GTP-recognition mechanism employed by all G proteins. Asymmetry also induces distinct inter-subunit interactions around the ring, suggesting a coordinated and directional GTP-hydrolysis cycle. Our data provide insights into the conserved molecular mechanisms governing McrB family AAA + motors. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20867.map.gz emd_20867.map.gz | 226.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20867-v30.xml emd-20867-v30.xml emd-20867.xml emd-20867.xml | 18.7 KB 18.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_20867_fsc.xml emd_20867_fsc.xml | 13.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_20867.png emd_20867.png | 77.8 KB | ||
| マスクデータ |  emd_20867_msk_1.map emd_20867_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-20867.cif.gz emd-20867.cif.gz | 6.4 KB | ||
| その他 |  emd_20867_half_map_1.map.gz emd_20867_half_map_1.map.gz emd_20867_half_map_2.map.gz emd_20867_half_map_2.map.gz | 195.4 MB 195.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20867 http://ftp.pdbj.org/pub/emdb/structures/EMD-20867 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20867 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20867 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20867_validation.pdf.gz emd_20867_validation.pdf.gz | 991.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20867_full_validation.pdf.gz emd_20867_full_validation.pdf.gz | 990.8 KB | 表示 | |
| XML形式データ |  emd_20867_validation.xml.gz emd_20867_validation.xml.gz | 18.1 KB | 表示 | |
| CIF形式データ |  emd_20867_validation.cif.gz emd_20867_validation.cif.gz | 24.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20867 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20867 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20867 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20867 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6ut6MC  6ut3C  6ut4C  6ut5C  6ut7C  6ut8C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10584 (タイトル: Single-particle Cryo-EM of the Escherichia coli McrBC complex EMPIAR-10584 (タイトル: Single-particle Cryo-EM of the Escherichia coli McrBC complexData size: 702.5 Data #1: Unaligned multi-frame micrographs of the Escherichia coli McrBC complex [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20867.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20867.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | FL-EcMcrBC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_20867_msk_1.map emd_20867_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_20867_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_20867_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of the full-length E. coli McrBC
| 全体 | 名称: Complex of the full-length E. coli McrBC |
|---|---|
| 要素 |
|
-超分子 #1: Complex of the full-length E. coli McrBC
| 超分子 | 名称: Complex of the full-length E. coli McrBC / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: 5-methylcytosine-specific restriction enzyme B
| 分子 | 名称: 5-methylcytosine-specific restriction enzyme B / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO EC番号: 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 53.212035 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MESIQPWIEK FIKQAQQQRS QSTKDYPTSY RNLRVKLSFG YGNFTSIPWF AFLGEGQEAS NGIYPVILYY KDFDELVLAY GISDTNEPH AQWQFSSDIP KTIAEYFQAT SGVYPKKYGQ SYYACSQKVS QGIDYTRFAS MLDNIINDYK LIFNSGKSVI P PMSKTESY ...文字列: MESIQPWIEK FIKQAQQQRS QSTKDYPTSY RNLRVKLSFG YGNFTSIPWF AFLGEGQEAS NGIYPVILYY KDFDELVLAY GISDTNEPH AQWQFSSDIP KTIAEYFQAT SGVYPKKYGQ SYYACSQKVS QGIDYTRFAS MLDNIINDYK LIFNSGKSVI P PMSKTESY CLEDALNDLF IPETTIETIL KRLTIKKNII LQGPPGVGKT FVARRLAYLL TGEKAPQRVN MVQFHQSYSY ED FIQGYRP NGVGFRRKDG IFYNFCQQAK EQPEKKYIFI IDEINRANLS KVFGEVMMLM EHDKRGENWS VPLTYSENDE ERF YVPENV YIIGLMNTAD RSLAVVDYAL RRRFSFIDIE PGFDTPQFRN FLLNKKAEPS FVESLCQKMN ELNQEISKEA TILG KGFRI GHSYFCCGLE DGTSPDTQWL NEIVMTDIAP LLEEYFFDDP YKQQKWTNKL LGDS UniProtKB: Type IV methyl-directed restriction enzyme EcoKMcrB subunit |
-分子 #2: Protein McrC
| 分子 | 名称: Protein McrC / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 40.643625 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MEQPVIPVRN IYYMLTYAWG YLQEIKQANL EAIPGNNLLD ILGYVLNKGV LQLSRRGLEL DYNPNTEIIP GIKGRIEFAK TIRGFHLNH GKTVSTFDML NEDTLANRII KSTLAILIKH EKLNSTIRDE ARSLYRKLPG ISTLHLTPQH FSYLNGGKNT R YYKFVISV ...文字列: MEQPVIPVRN IYYMLTYAWG YLQEIKQANL EAIPGNNLLD ILGYVLNKGV LQLSRRGLEL DYNPNTEIIP GIKGRIEFAK TIRGFHLNH GKTVSTFDML NEDTLANRII KSTLAILIKH EKLNSTIRDE ARSLYRKLPG ISTLHLTPQH FSYLNGGKNT R YYKFVISV CKFIVNNSIP GQNKGHYRFY DFERNEKEMS LLYQKFLYEF CRRELTSANT TRSYLKWDAS SISDQSLNLL PR METDITI RSSEKILIVD AKYYKSIFSR RMGTEKFHSQ NLYQLMNYLW SLKPENGENI GGLLIYPHVD TAVKHRYKIN GFD IGLCTV NLGQEWPCIH QELLDIFDEY LK UniProtKB: Type IV methyl-directed restriction enzyme EcoKMcrBC |
-分子 #3: GUANOSINE-5'-DIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: GDP |
|---|---|
| 分子量 | 理論値: 443.201 Da |
| Chemical component information |  ChemComp-GDP: |
-分子 #4: 5'-GUANOSINE-DIPHOSPHATE-MONOTHIOPHOSPHATE
| 分子 | 名称: 5'-GUANOSINE-DIPHOSPHATE-MONOTHIOPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 5 / 式: GSP |
|---|---|
| 分子量 | 理論値: 539.246 Da |
| Chemical component information | 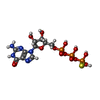 ChemComp-GSP: |
-分子 #5: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 5 / コピー数: 4 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 16.0 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 1161 / 平均露光時間: 20.0 sec. / 平均電子線量: 4.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)