+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8eff | ||||||
|---|---|---|---|---|---|---|---|
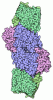
| タイトル | CryoEM of the soluble OPA1 tetramer from the GDP-AlFx bound helical assembly on a lipid membrane | ||||||
 要素 要素 | Dynamin-like 120 kDa protein, form S1 | ||||||
 キーワード キーワード | LIPID BINDING PROTEIN /  GTPase (GTPアーゼ) / Dynamin-family protein / GTPase (GTPアーゼ) / Dynamin-family protein /  mitochondrial fusion protein / mitochondrial fusion protein /  mitochondria (ミトコンドリア) / mitochondria (ミトコンドリア) /  Optic Atrophy Optic Atrophy | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 Regulation of Apoptosis / membrane tubulation / inner mitochondrial membrane organization / Regulation of Apoptosis / membrane tubulation / inner mitochondrial membrane organization /  dynamin GTPase / dynamin GTPase /  cardiolipin binding / cardiolipin binding /  mitochondrial genome maintenance / mitochondrial genome maintenance /  phosphatidic acid binding / phosphatidic acid binding /  mitochondrial fission / GTP metabolic process / mitochondrial fission / GTP metabolic process /  mitochondrial fusion ... mitochondrial fusion ... Regulation of Apoptosis / membrane tubulation / inner mitochondrial membrane organization / Regulation of Apoptosis / membrane tubulation / inner mitochondrial membrane organization /  dynamin GTPase / dynamin GTPase /  cardiolipin binding / cardiolipin binding /  mitochondrial genome maintenance / mitochondrial genome maintenance /  phosphatidic acid binding / phosphatidic acid binding /  mitochondrial fission / GTP metabolic process / mitochondrial fission / GTP metabolic process /  mitochondrial fusion / axonal transport of mitochondrion / negative regulation of release of cytochrome c from mitochondria / mitochondrial crista / negative regulation of endoplasmic reticulum stress-induced intrinsic apoptotic signaling pathway / axon cytoplasm / mitochondrial fusion / axonal transport of mitochondrion / negative regulation of release of cytochrome c from mitochondria / mitochondrial crista / negative regulation of endoplasmic reticulum stress-induced intrinsic apoptotic signaling pathway / axon cytoplasm /  視覚 / mitochondrion organization / neural tube closure / 視覚 / mitochondrion organization / neural tube closure /  ミトコンドリア / ミトコンドリア /  ミトコンドリア / ミトコンドリア /  細胞老化 / protein complex oligomerization / 細胞老化 / protein complex oligomerization /  microtubule binding / microtubule binding /  ミトコンドリア内膜 / ミトコンドリア内膜 /  微小管 / mitochondrial outer membrane / 微小管 / mitochondrial outer membrane /  GTPase activity / GTPase activity /  樹状突起 / apoptotic process / GTP binding / negative regulation of apoptotic process / magnesium ion binding / 樹状突起 / apoptotic process / GTP binding / negative regulation of apoptotic process / magnesium ion binding /  ミトコンドリア / ミトコンドリア /  核質 / 核質 /  生体膜 / 生体膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / らせん対称体再構成法 / 電子顕微鏡法 / らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 5.48 Å クライオ電子顕微鏡法 / 解像度: 5.48 Å | ||||||
 データ登録者 データ登録者 | Nyenhuis, S.B. / Wu, X. / Stanton, A.E. / Strub, M.P. / Yim, Y.I. / Canagarajah, B. / Hinshaw, J.E. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: OPA1 helical structures give perspective to mitochondrial dysfunction. 著者: Sarah B Nyenhuis / Xufeng Wu / Marie-Paule Strub / Yang-In Yim / Abigail E Stanton / Valentina Baena / Zulfeqhar A Syed / Bertram Canagarajah / John A Hammer / Jenny E Hinshaw /  要旨: Dominant optic atrophy is one of the leading causes of childhood blindness. Around 60-80% of cases are caused by mutations of the gene that encodes optic atrophy protein 1 (OPA1), a protein that has ...Dominant optic atrophy is one of the leading causes of childhood blindness. Around 60-80% of cases are caused by mutations of the gene that encodes optic atrophy protein 1 (OPA1), a protein that has a key role in inner mitochondrial membrane fusion and remodelling of cristae and is crucial for the dynamic organization and regulation of mitochondria. Mutations in OPA1 result in the dysregulation of the GTPase-mediated fusion process of the mitochondrial inner and outer membranes. Here we used cryo-electron microscopy methods to solve helical structures of OPA1 assembled on lipid membrane tubes, in the presence and absence of nucleotide. These helical assemblies organize into densely packed protein rungs with minimal inter-rung connectivity, and exhibit nucleotide-dependent dimerization of the GTPase domains-a hallmark of the dynamin superfamily of proteins. OPA1 also contains several unique secondary structures in the paddle domain that strengthen its membrane association, including membrane-inserting helices. The structural features identified in this study shed light on the effects of pathogenic point mutations on protein folding, inter-protein assembly and membrane interactions. Furthermore, mutations that disrupt the assembly interfaces and membrane binding of OPA1 cause mitochondrial fragmentation in cell-based assays, providing evidence of the biological relevance of these interactions. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8eff.cif.gz 8eff.cif.gz | 1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8eff.ent.gz pdb8eff.ent.gz | 883.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8eff.json.gz 8eff.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ef/8eff https://data.pdbj.org/pub/pdb/validation_reports/ef/8eff ftp://data.pdbj.org/pub/pdb/validation_reports/ef/8eff ftp://data.pdbj.org/pub/pdb/validation_reports/ef/8eff | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  28063MC  8eewC  8ef7C  8efrC  8efsC  8eftC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 89262.516 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: OPA1, KIAA0567 / プラスミド: pET28a / 発現宿主: Homo sapiens (ヒト) / 遺伝子: OPA1, KIAA0567 / プラスミド: pET28a / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / Variant (発現宿主): RIL / 参照: UniProt: O60313 Escherichia coli BL21(DE3) (大腸菌) / Variant (発現宿主): RIL / 参照: UniProt: O60313#2: 化合物 | ChemComp-GDP /  グアノシン二リン酸 グアノシン二リン酸#3: 化合物 | ChemComp-ALF / #4: 化合物 | ChemComp-MG / #5: 化合物 | ChemComp-K / 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: HELICAL ARRAY / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: cryoEM of the soluble OPA1 tetramer from the GDP-AlFx bound helical assembly on a lipid membrane タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:   Escherichia coli (大腸菌) / 株: RIL Escherichia coli (大腸菌) / 株: RIL |
| 緩衝液 | pH: 7.2 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 300 nm Bright-field microscopy / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 300 nm |
| 撮影 | 電子線照射量: 60 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア |
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||
| らせん対称 | 回転角度/サブユニット: 37.439 ° / 軸方向距離/サブユニット: 12.933 Å / らせん対称軸の対称性: C1 | |||||||||
3次元再構成 | 解像度: 5.48 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 598503 / 対称性のタイプ: HELICAL | |||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | |||||||||
| 原子モデル構築 | PDB-ID: 6JTG |
 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj