+ データを開く
データを開く
- 基本情報
基本情報
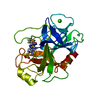
| 登録情報 | データベース: PDB / ID: 6svd | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Non-terahertz irradiated structure of bovine trypsin (even frames of crystal x41) | |||||||||
 要素 要素 | Cationic trypsin | |||||||||
 キーワード キーワード |  HYDROLASE (加水分解酵素) / bovine trypsin / Terahertz irradiation / even frames / x41 HYDROLASE (加水分解酵素) / bovine trypsin / Terahertz irradiation / even frames / x41 | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 トリプシン / トリプシン /  serpin family protein binding / serpin family protein binding /  serine protease inhibitor complex / serine protease inhibitor complex /  消化 / 消化 /  endopeptidase activity / serine-type endopeptidase activity / endopeptidase activity / serine-type endopeptidase activity /  タンパク質分解 / タンパク質分解 /  extracellular space / extracellular space /  metal ion binding metal ion binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Bos taurus (ウシ) Bos taurus (ウシ) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.15 Å 分子置換 / 解像度: 1.15 Å | |||||||||
 データ登録者 データ登録者 | Ahlberg Gagner, V. / Lundholm, I. / Garcia-Bonete, M.J. / Rodilla, H. / Friedman, R. / Zhaunerchyk, V. / Bourenkov, G. / Schneider, T. / Stake, J. / Katona, G. | |||||||||
| 資金援助 |  スウェーデン, 2件 スウェーデン, 2件
| |||||||||
 引用 引用 |  ジャーナル: Sci Rep / 年: 2019 ジャーナル: Sci Rep / 年: 2019タイトル: Clustering of atomic displacement parameters in bovine trypsin reveals a distributed lattice of atoms with shared chemical properties. 著者: Gagner, V.A. / Lundholm, I. / Garcia-Bonete, M.J. / Rodilla, H. / Friedman, R. / Zhaunerchyk, V. / Bourenkov, G. / Schneider, T. / Stake, J. / Katona, G. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6svd.cif.gz 6svd.cif.gz | 112.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6svd.ent.gz pdb6svd.ent.gz | 89.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6svd.json.gz 6svd.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/sv/6svd https://data.pdbj.org/pub/pdb/validation_reports/sv/6svd ftp://data.pdbj.org/pub/pdb/validation_reports/sv/6svd ftp://data.pdbj.org/pub/pdb/validation_reports/sv/6svd | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  6suxC  6sv0C  6sv6C  6sv8C  6sv9C  6svbC  6svgC  6sviC  6svjC  6svnC  6svrC  6svuC  6svvC  6svwC  6svxC  6svzC  6sw0C  418gS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 23324.287 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Bos taurus (ウシ) / 参照: UniProt: P00760, Bos taurus (ウシ) / 参照: UniProt: P00760,  トリプシン トリプシン | ||||
|---|---|---|---|---|---|
| #2: 化合物 | ChemComp-CA / | ||||
| #3: 化合物 | ChemComp-BEN /  ベンザミジン ベンザミジン | ||||
| #4: 化合物 |  硫酸塩 硫酸塩#5: 水 | ChemComp-HOH / |  水 水研究の焦点であるリガンドがあるか | N | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.1 Å3/Da / 溶媒含有率: 41.49 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 7 詳細: protein solution - 60 mg/ml trypsin, 6 mg/ml benzamidine and 3 mM CaCl2 in a 30 mM HEPES buffer pH 7.0. Well solution - 18% PEG 8000, 200 mM (NH4)2SO4, 50 mM HEPES pH 7, 3 mM CaCl2 and 6 ...詳細: protein solution - 60 mg/ml trypsin, 6 mg/ml benzamidine and 3 mM CaCl2 in a 30 mM HEPES buffer pH 7.0. Well solution - 18% PEG 8000, 200 mM (NH4)2SO4, 50 mM HEPES pH 7, 3 mM CaCl2 and 6 mg/ml benzamidine. 1:1 ratio drops |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  PETRA III, EMBL c/o DESY PETRA III, EMBL c/o DESY  / ビームライン: P14 (MX2) / 波長: 0.8856 Å / ビームライン: P14 (MX2) / 波長: 0.8856 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS 6M-F / 検出器: PIXEL / 日付: 2015年10月23日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 0.8856 Å / 相対比: 1 : 0.8856 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.15→43.05 Å / Num. obs: 129047 / % possible obs: 94.6 % / 冗長度: 5.663 % / Biso Wilson estimate: 12.992 Å2 / CC1/2: 0.995 / Rmerge(I) obs: 0.195 / Rrim(I) all: 0.214 / Χ2: 1.083 / Net I/σ(I): 7.81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 418G 解像度: 1.15→43.05 Å / 交差検証法: FREE R-VALUE
| ||||||||||||||||
| 原子変位パラメータ | Biso mean: 12.265 Å2 | ||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.15→43.05 Å
|
 ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj