+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ktc | ||||||
|---|---|---|---|---|---|---|---|
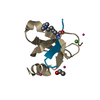
| タイトル | Crystal structure of YBX1 CSD with m5C RNA | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | RNA BINDING PROTEIN/RNA / m5C / CSD / RNA BINDING PROTEIN-RNA complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報tRNA transport / CRD-mediated mRNA stability complex / C5-methylcytidine-containing RNA reader activity / miRNA transport / negative regulation of striated muscle cell differentiation / RNA transport / Noncanonical activation of NOTCH3 / negative regulation of nuclear-transcribed mRNA catabolic process, deadenylation-dependent decay / CRD-mediated mRNA stabilization / protein localization to cytoplasmic stress granule ...tRNA transport / CRD-mediated mRNA stability complex / C5-methylcytidine-containing RNA reader activity / miRNA transport / negative regulation of striated muscle cell differentiation / RNA transport / Noncanonical activation of NOTCH3 / negative regulation of nuclear-transcribed mRNA catabolic process, deadenylation-dependent decay / CRD-mediated mRNA stabilization / protein localization to cytoplasmic stress granule /  messenger ribonucleoprotein complex / histone pre-mRNA 3'end processing complex / embryonic morphogenesis / U12-type spliceosomal complex / positive regulation of cytoplasmic translation / mRNA stabilization / cellular response to interleukin-7 / miRNA binding / mRNA Splicing - Minor Pathway / negative regulation of cellular senescence / Processing of Capped Intron-Containing Pre-mRNA / positive regulation of cell division / epidermis development / mRNA Splicing - Major Pathway / messenger ribonucleoprotein complex / histone pre-mRNA 3'end processing complex / embryonic morphogenesis / U12-type spliceosomal complex / positive regulation of cytoplasmic translation / mRNA stabilization / cellular response to interleukin-7 / miRNA binding / mRNA Splicing - Minor Pathway / negative regulation of cellular senescence / Processing of Capped Intron-Containing Pre-mRNA / positive regulation of cell division / epidermis development / mRNA Splicing - Major Pathway /  RNA splicing / RNA splicing /  P-body / SMAD2/SMAD3:SMAD4 heterotrimer regulates transcription / P-body / SMAD2/SMAD3:SMAD4 heterotrimer regulates transcription /  転写後修飾 / cytoplasmic stress granule / Interferon gamma signaling / sequence-specific double-stranded DNA binding / 転写後修飾 / cytoplasmic stress granule / Interferon gamma signaling / sequence-specific double-stranded DNA binding /  single-stranded DNA binding / single-stranded DNA binding /  GTPase binding / GTPase binding /  double-stranded DNA binding / double-stranded DNA binding /  遺伝子発現の調節 / in utero embryonic development / negative regulation of translation / 遺伝子発現の調節 / in utero embryonic development / negative regulation of translation /  nucleic acid binding / nucleic acid binding /  ribonucleoprotein complex / ribonucleoprotein complex /  mRNA binding / intracellular membrane-bounded organelle / mRNA binding / intracellular membrane-bounded organelle /  シナプス / シナプス /  chromatin binding / regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II / chromatin binding / regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II /  小胞体 / positive regulation of transcription by RNA polymerase II / 小胞体 / positive regulation of transcription by RNA polymerase II /  DNA binding / DNA binding /  RNA binding / extracellular exosome / extracellular region / RNA binding / extracellular exosome / extracellular region /  核質 / 核質 /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.008 Å 分子置換 / 解像度: 2.008 Å | ||||||
 データ登録者 データ登録者 | Zou, F. / Li, S. | ||||||
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2020 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2020タイトル: DrosophilaYBX1 homolog YPS promotes ovarian germ line stem cell development by preferentially recognizing 5-methylcytosine RNAs. 著者: Zou, F. / Tu, R. / Duan, B. / Yang, Z. / Ping, Z. / Song, X. / Chen, S. / Price, A. / Li, H. / Scott, A. / Perera, A. / Li, S. / Xie, T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ktc.cif.gz 6ktc.cif.gz | 50.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ktc.ent.gz pdb6ktc.ent.gz | 33.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6ktc.json.gz 6ktc.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/kt/6ktc https://data.pdbj.org/pub/pdb/validation_reports/kt/6ktc ftp://data.pdbj.org/pub/pdb/validation_reports/kt/6ktc ftp://data.pdbj.org/pub/pdb/validation_reports/kt/6ktc | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 8710.782 Da / 分子数: 1 / 断片: CSD domain / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: YBX1, NSEP1, YB1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: YBX1, NSEP1, YB1 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P67809 Escherichia coli (大腸菌) / 参照: UniProt: P67809 |
|---|---|
| #2: RNA鎖 | 分子量: 1230.804 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| #3: 水 | ChemComp-HOH /  水 水 |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.21 Å3/Da / 溶媒含有率: 44.37 % |
|---|---|
結晶化 | 温度: 297 K / 手法: 蒸気拡散法, シッティングドロップ法 / 詳細: 2.5 M Ammonium sulfate, 0.1 M Tris pH 8.5. |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SSRF SSRF  / ビームライン: BL19U1 / 波長: 0.9789 Å / ビームライン: BL19U1 / 波長: 0.9789 Å |
| 検出器 | タイプ: DECTRIS PILATUS3 6M / 検出器: PIXEL / 日付: 2018年6月25日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.9789 Å / 相対比: 1 : 0.9789 Å / 相対比: 1 |
| 反射 | 解像度: 2→50 Å / Num. obs: 5075 / % possible obs: 97.8 % / 冗長度: 13.2 % / Rsym value: 0.131 / Net I/σ(I): 17.4 |
| 反射 シェル | 解像度: 2→2.03 Å / 冗長度: 8.9 % / Mean I/σ(I) obs: 4.7 / Num. unique obs: 265 / Rsym value: 0.305 / % possible all: 86.9 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 3I2Z 解像度: 2.008→33.353 Å / SU ML: 0.26 / 交差検証法: FREE R-VALUE / σ(F): 1.39 / 位相誤差: 31.62
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.008→33.353 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj





