+ データを開く
データを開く
- 基本情報
基本情報
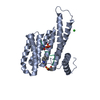
| 登録情報 | データベース: PDB / ID: 4hkc | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | 14-3-3-zeta in complex with S1011 phosphorylated integrin alpha-4 peptide | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  SIGNALING PROTEIN/PEPTIDE / SIGNALING PROTEIN/PEPTIDE /  14-3-3 (14-3-3タンパク質) / all-helical protein / regulatory / alpha-4 integrin tail / 14-3-3 (14-3-3タンパク質) / all-helical protein / regulatory / alpha-4 integrin tail /  phosphorylation (リン酸化) / phosphorylation (リン酸化) /  SIGNAL TRANSDUCTION (シグナル伝達) / SIGNAL TRANSDUCTION (シグナル伝達) /  SIGNALING PROTEIN-PEPTIDE complex SIGNALING PROTEIN-PEPTIDE complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報clathrin-dependent extracellular exosome endocytosis /  immune response in gut-associated lymphoid tissue / cell-matrix adhesion involved in ameboidal cell migration / integrin alpha4-beta7 complex / negative regulation of protein homodimerization activity / immune response in gut-associated lymphoid tissue / cell-matrix adhesion involved in ameboidal cell migration / integrin alpha4-beta7 complex / negative regulation of protein homodimerization activity /  cell-cell adhesion in response to extracellular stimulus / cell-cell adhesion in response to extracellular stimulus /  diapedesis / cell-cell adhesion mediated by integrin / integrin alpha4-beta1 complex / Golgi reassembly ...clathrin-dependent extracellular exosome endocytosis / diapedesis / cell-cell adhesion mediated by integrin / integrin alpha4-beta1 complex / Golgi reassembly ...clathrin-dependent extracellular exosome endocytosis /  immune response in gut-associated lymphoid tissue / cell-matrix adhesion involved in ameboidal cell migration / integrin alpha4-beta7 complex / negative regulation of protein homodimerization activity / immune response in gut-associated lymphoid tissue / cell-matrix adhesion involved in ameboidal cell migration / integrin alpha4-beta7 complex / negative regulation of protein homodimerization activity /  cell-cell adhesion in response to extracellular stimulus / cell-cell adhesion in response to extracellular stimulus /  diapedesis / cell-cell adhesion mediated by integrin / integrin alpha4-beta1 complex / Golgi reassembly / positive regulation of leukocyte tethering or rolling / axonogenesis involved in innervation / regulation of synapse maturation / NOTCH4 Activation and Transmission of Signal to the Nucleus / protein antigen binding / establishment of Golgi localization / leukocyte tethering or rolling / RUNX3 Regulates Immune Response and Cell Migration / Rap1 signalling / positive regulation of endothelial cell apoptotic process / heterotypic cell-cell adhesion / diapedesis / cell-cell adhesion mediated by integrin / integrin alpha4-beta1 complex / Golgi reassembly / positive regulation of leukocyte tethering or rolling / axonogenesis involved in innervation / regulation of synapse maturation / NOTCH4 Activation and Transmission of Signal to the Nucleus / protein antigen binding / establishment of Golgi localization / leukocyte tethering or rolling / RUNX3 Regulates Immune Response and Cell Migration / Rap1 signalling / positive regulation of endothelial cell apoptotic process / heterotypic cell-cell adhesion /  integrin complex / negative regulation of protein localization to nucleus / positive regulation of vascular endothelial cell proliferation / cell adhesion mediated by integrin / neuron projection extension / KSRP (KHSRP) binds and destabilizes mRNA / negative regulation of vasoconstriction / leukocyte cell-cell adhesion / GP1b-IX-V activation signalling / receptor clustering / endodermal cell differentiation / cellular response to cytokine stimulus / integrin complex / negative regulation of protein localization to nucleus / positive regulation of vascular endothelial cell proliferation / cell adhesion mediated by integrin / neuron projection extension / KSRP (KHSRP) binds and destabilizes mRNA / negative regulation of vasoconstriction / leukocyte cell-cell adhesion / GP1b-IX-V activation signalling / receptor clustering / endodermal cell differentiation / cellular response to cytokine stimulus /  fibronectin binding / Regulation of localization of FOXO transcription factors / fibronectin binding / Regulation of localization of FOXO transcription factors /  Interleukin-3, Interleukin-5 and GM-CSF signaling / phosphoserine residue binding / Activation of BAD and translocation to mitochondria / positive regulation of T cell migration / cellular response to glucose starvation / Integrin cell surface interactions / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / Interleukin-3, Interleukin-5 and GM-CSF signaling / phosphoserine residue binding / Activation of BAD and translocation to mitochondria / positive regulation of T cell migration / cellular response to glucose starvation / Integrin cell surface interactions / SARS-CoV-2 targets host intracellular signalling and regulatory pathways /  coreceptor activity / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / RHO GTPases activate PKNs / negative regulation of TORC1 signaling / negative regulation of innate immune response / coreceptor activity / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / RHO GTPases activate PKNs / negative regulation of TORC1 signaling / negative regulation of innate immune response /  cell adhesion molecule binding / substrate adhesion-dependent cell spreading / cell-matrix adhesion / regulation of ERK1 and ERK2 cascade / B cell differentiation / protein sequestering activity / integrin-mediated signaling pathway / Translocation of SLC2A4 (GLUT4) to the plasma membrane / Deactivation of the beta-catenin transactivating complex / Cell surface interactions at the vascular wall / TP53 Regulates Metabolic Genes / Negative regulation of NOTCH4 signaling / cell adhesion molecule binding / substrate adhesion-dependent cell spreading / cell-matrix adhesion / regulation of ERK1 and ERK2 cascade / B cell differentiation / protein sequestering activity / integrin-mediated signaling pathway / Translocation of SLC2A4 (GLUT4) to the plasma membrane / Deactivation of the beta-catenin transactivating complex / Cell surface interactions at the vascular wall / TP53 Regulates Metabolic Genes / Negative regulation of NOTCH4 signaling /  細胞接着 / cellular response to amyloid-beta / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / 細胞接着 / cellular response to amyloid-beta / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell /  メラノソーム / メラノソーム /  integrin binding / integrin binding /  成長円錐 / blood microparticle / DNA-binding transcription factor binding / vesicle / Potential therapeutics for SARS / transmembrane transporter binding / 成長円錐 / blood microparticle / DNA-binding transcription factor binding / vesicle / Potential therapeutics for SARS / transmembrane transporter binding /  cadherin binding / external side of plasma membrane / cadherin binding / external side of plasma membrane /  protein phosphorylation / protein phosphorylation /  focal adhesion / neuronal cell body / glutamatergic synapse / focal adhesion / neuronal cell body / glutamatergic synapse /  ubiquitin protein ligase binding / negative regulation of apoptotic process / ubiquitin protein ligase binding / negative regulation of apoptotic process /  protein kinase binding / negative regulation of transcription by RNA polymerase II / protein kinase binding / negative regulation of transcription by RNA polymerase II /  細胞膜 / 細胞膜 /  シグナル伝達 / シグナル伝達 /  extracellular space / extracellular space /  RNA binding / extracellular exosome / RNA binding / extracellular exosome /  核質 / 核質 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å | ||||||
 データ登録者 データ登録者 | Bonet, R. / Campbell, I.D. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2013 ジャーナル: J.Mol.Biol. / 年: 2013タイトル: Characterization of 14-3-3-zeta Interactions with integrin tails 著者: Bonet, R. / Vakonakis, I. / Campbell, I.D. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4hkc.cif.gz 4hkc.cif.gz | 111.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4hkc.ent.gz pdb4hkc.ent.gz | 85.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4hkc.json.gz 4hkc.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hk/4hkc https://data.pdbj.org/pub/pdb/validation_reports/hk/4hkc ftp://data.pdbj.org/pub/pdb/validation_reports/hk/4hkc ftp://data.pdbj.org/pub/pdb/validation_reports/hk/4hkc | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  2o02S S: 精密化の開始モデル |
|---|---|
| 類似構造データ | |
| その他のデータベース |
|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 28188.545 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: N-terminal His-tag followed by a 3C protease cleavage site 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: YWHAZ / プラスミド: pET16-b / 発現宿主: Homo sapiens (ヒト) / 遺伝子: YWHAZ / プラスミド: pET16-b / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P63104 Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P63104 |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 3797.991 Da / 分子数: 1 / Fragment: UNP residues 1003-1032 / 由来タイプ: 合成 詳細: Chemically synthesized peptide corresponding to alpha-4 integrin tail 由来: (合成)   Homo sapiens (ヒト) / 参照: UniProt: P13612 Homo sapiens (ヒト) / 参照: UniProt: P13612 |
| #3: 化合物 | ChemComp-GOL /  グリセリン グリセリン |
| #4: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.83 Å3/Da / 溶媒含有率: 56.6 % |
|---|---|
結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.5 詳細: 0.1M Na HEPES (pH 7.5), 25% PEG 2000 MME, VAPOR DIFFUSION, SITTING DROP, temperature 277K |
-データ収集
| 回折 | 平均測定温度: 298 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Diamond Diamond  / ビームライン: I04-1 / 波長: 0.9163 Å / ビームライン: I04-1 / 波長: 0.9163 Å |
| 検出器 | タイプ: MARMOSAIC 300 mm CCD / 検出器: CCD / 日付: 2011年1月28日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.9163 Å / 相対比: 1 : 0.9163 Å / 相対比: 1 |
| 反射 | 解像度: 2.2→44.5 Å / Num. all: 18798 / Num. obs: 18798 / % possible obs: 99.8 % / Observed criterion σ(F): 2 / Observed criterion σ(I): 2 / 冗長度: 5.9 % / Biso Wilson estimate: 49.47 Å2 / Net I/σ(I): 9.8 |
| 反射 シェル | 解像度: 2.2→2.32 Å / 冗長度: 5.8 % / Rmerge(I) obs: 0.394 / Mean I/σ(I) obs: 3.2 / Num. unique all: 2725 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 2O02 解像度: 2.2→34.8 Å / Cor.coef. Fo:Fc: 0.9507 / Cor.coef. Fo:Fc free: 0.9375 / SU R Cruickshank DPI: 0.192 / 交差検証法: THROUGHOUT / σ(F): 0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 60.17 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.357 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.2→34.8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.2→2.33 Å / Total num. of bins used: 9
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Origin x: 22.1337 Å / Origin y: 7.89 Å / Origin z: 17.4031 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ | Selection details: { A|2 - A|230 } |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj















