登録情報 データベース : PDB / ID : 4gvcタイトル Crystal Structure of T-cell Lymphoma Invasion and Metastasis-1 PDZ in complex with phosphorylated Syndecan1 Peptide Syndecan-1 T-lymphoma invasion and metastasis-inducing protein 1 キーワード / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 1.54 Å データ登録者 Liu, X. / Shepherd, T.R. / Murray, A.M. / Xu, Z. / Fuentes, E.J. ジャーナル : Structure / 年 : 2013タイトル : The structure of the Tiam1 PDZ domain/ phospho-syndecan1 complex reveals a ligand conformation that modulates protein dynamics.著者 : Liu, X. / Shepherd, T.R. / Murray, A.M. / Xu, Z. / Fuentes, E.J. 履歴 登録 2012年8月30日 登録サイト / 処理サイト 改定 1.0 2013年3月13日 Provider / タイプ 改定 1.1 2015年5月27日 Group 改定 1.2 2023年9月13日 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_conn / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id 改定 1.3 2023年12月6日 Group / カテゴリ / chem_comp_bond / Item / _chem_comp_bond.atom_id_2
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード SIGNALING PROTEIN /
SIGNALING PROTEIN /  phosphorylation (リン酸化) / peptide conformational change / new binding pocket / scaffold signaling protein for cell adhesion and cell junction / syndecan1 P1 Tyr phosphorylation / sydencan1 N-terminal Thr dansylation
phosphorylation (リン酸化) / peptide conformational change / new binding pocket / scaffold signaling protein for cell adhesion and cell junction / syndecan1 P1 Tyr phosphorylation / sydencan1 N-terminal Thr dansylation 機能・相同性情報
機能・相同性情報 extrinsic component of postsynaptic density membrane / HS-GAG biosynthesis / HS-GAG degradation / positive regulation of extracellular exosome assembly / Activated NTRK2 signals through CDK5 / Sertoli cell development /
extrinsic component of postsynaptic density membrane / HS-GAG biosynthesis / HS-GAG degradation / positive regulation of extracellular exosome assembly / Activated NTRK2 signals through CDK5 / Sertoli cell development /  regulation of epithelial to mesenchymal transition / positive regulation of dendritic spine morphogenesis / regulation of insulin secretion involved in cellular response to glucose stimulus / regulation of modification of postsynaptic actin cytoskeleton / cell-cell contact zone / positive regulation of exosomal secretion / protein localization to membrane / cardiac muscle hypertrophy / activation of GTPase activity / cargo receptor activity /
regulation of epithelial to mesenchymal transition / positive regulation of dendritic spine morphogenesis / regulation of insulin secretion involved in cellular response to glucose stimulus / regulation of modification of postsynaptic actin cytoskeleton / cell-cell contact zone / positive regulation of exosomal secretion / protein localization to membrane / cardiac muscle hypertrophy / activation of GTPase activity / cargo receptor activity /  Wnt signaling pathway, planar cell polarity pathway / regulation of small GTPase mediated signal transduction / ureteric bud development / main axon / neuron projection extension / Syndecan interactions / positive regulation of axonogenesis / Other interleukin signaling / small GTPase-mediated signal transduction / NRAGE signals death through JNK / Rac protein signal transduction / CDC42 GTPase cycle / EPH-ephrin mediated repulsion of cells / RHOA GTPase cycle / canonical Wnt signaling pathway / ephrin receptor signaling pathway / RAC2 GTPase cycle / RAC3 GTPase cycle / positive regulation of epithelial to mesenchymal transition / axonal growth cone / Retinoid metabolism and transport / response to glucocorticoid / response to cAMP / EPHB-mediated forward signaling / RAC1 GTPase cycle / lysosomal lumen /
Wnt signaling pathway, planar cell polarity pathway / regulation of small GTPase mediated signal transduction / ureteric bud development / main axon / neuron projection extension / Syndecan interactions / positive regulation of axonogenesis / Other interleukin signaling / small GTPase-mediated signal transduction / NRAGE signals death through JNK / Rac protein signal transduction / CDC42 GTPase cycle / EPH-ephrin mediated repulsion of cells / RHOA GTPase cycle / canonical Wnt signaling pathway / ephrin receptor signaling pathway / RAC2 GTPase cycle / RAC3 GTPase cycle / positive regulation of epithelial to mesenchymal transition / axonal growth cone / Retinoid metabolism and transport / response to glucocorticoid / response to cAMP / EPHB-mediated forward signaling / RAC1 GTPase cycle / lysosomal lumen /  receptor-mediated endocytosis / cell-matrix adhesion / regulation of ERK1 and ERK2 cascade / guanyl-nucleotide exchange factor activity / response to cocaine / Cell surface interactions at the vascular wall / response to hydrogen peroxide /
receptor-mediated endocytosis / cell-matrix adhesion / regulation of ERK1 and ERK2 cascade / guanyl-nucleotide exchange factor activity / response to cocaine / Cell surface interactions at the vascular wall / response to hydrogen peroxide /  receptor tyrosine kinase binding / response to toxic substance / ruffle membrane /
receptor tyrosine kinase binding / response to toxic substance / ruffle membrane /  kinase binding / Golgi lumen / response to calcium ion / G alpha (12/13) signalling events /
kinase binding / Golgi lumen / response to calcium ion / G alpha (12/13) signalling events /  遊走 / cell-cell junction / positive regulation of protein binding /
遊走 / cell-cell junction / positive regulation of protein binding /  microtubule binding / protein-containing complex assembly /
microtubule binding / protein-containing complex assembly /  微小管 /
微小管 /  樹状突起スパイン / Attachment and Entry / positive regulation of cell migration / external side of plasma membrane / neuronal cell body /
樹状突起スパイン / Attachment and Entry / positive regulation of cell migration / external side of plasma membrane / neuronal cell body /  シナプス / glutamatergic synapse /
シナプス / glutamatergic synapse /  lipid binding / positive regulation of cell population proliferation /
lipid binding / positive regulation of cell population proliferation /  細胞膜 / protein-containing complex / extracellular exosome / identical protein binding /
細胞膜 / protein-containing complex / extracellular exosome / identical protein binding /  細胞膜 /
細胞膜 /  細胞質基質
細胞質基質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.54 Å
分子置換 / 解像度: 1.54 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2013
ジャーナル: Structure / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4gvc.cif.gz
4gvc.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4gvc.ent.gz
pdb4gvc.ent.gz PDB形式
PDB形式 4gvc.json.gz
4gvc.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/gv/4gvc
https://data.pdbj.org/pub/pdb/validation_reports/gv/4gvc ftp://data.pdbj.org/pub/pdb/validation_reports/gv/4gvc
ftp://data.pdbj.org/pub/pdb/validation_reports/gv/4gvc リンク
リンク 集合体
集合体
 要素
要素
 Homo sapiens (ヒト) / 株: human
Homo sapiens (ヒト) / 株: human ヒト / 遺伝子: TIAM1 / プラスミド: PET21A-6HIS-rTEV / 発現宿主:
ヒト / 遺伝子: TIAM1 / プラスミド: PET21A-6HIS-rTEV / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: Q13009
Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: Q13009 Syndecan 1 / SYND1
Syndecan 1 / SYND1
 Homo sapiens (ヒト) / 参照: UniProt: P18827
Homo sapiens (ヒト) / 参照: UniProt: P18827
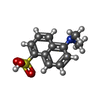





 塩化物
塩化物 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  ALS
ALS  / ビームライン: 4.2.2 / 波長: 1 Å
/ ビームライン: 4.2.2 / 波長: 1 Å : 1 Å / 相対比: 1
: 1 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj




















