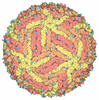
登録情報 データベース : PDB / ID : 2b6bタイトル Cryo EM structure of Dengue complexed with CRD of DC-SIGN CD209 antigen envelope glycoprotein キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 25 Å データ登録者 Pokidysheva, E. / Zhang, Y. / Battisti, A.J. / Bator-Kelly, C.M. / Chipman, P.R. / Gregorio, G. / Hendrickson, W.A. / Kuhn, R.J. / Rossmann, M.G. ジャーナル : Cell / 年 : 2006タイトル : Cryo-EM reconstruction of dengue virus in complex with the carbohydrate recognition domain of DC-SIGN.著者 : Elena Pokidysheva / Ying Zhang / Anthony J Battisti / Carol M Bator-Kelly / Paul R Chipman / Chuan Xiao / G Glenn Gregorio / Wayne A Hendrickson / Richard J Kuhn / Michael G Rossmann / 要旨 : Dengue virus (DENV) is a significant human pathogen that causes millions of infections and results in about 24,000 deaths each year. Dendritic cell-specific ICAM3 grabbing nonintegrin (DC-SIGN), ... Dengue virus (DENV) is a significant human pathogen that causes millions of infections and results in about 24,000 deaths each year. Dendritic cell-specific ICAM3 grabbing nonintegrin (DC-SIGN), abundant in immature dendritic cells, was previously reported as being an ancillary receptor interacting with the surface of DENV. The structure of DENV in complex with the carbohydrate recognition domain (CRD) of DC-SIGN was determined by cryo-electron microscopy at 25 A resolution. One CRD monomer was found to bind to two glycosylation sites at Asn67 of two neighboring glycoproteins in each icosahedral asymmetric unit, leaving the third Asn67 residue vacant. The vacancy at the third Asn67 site is a result of the nonequivalence of the glycoprotein environments, leaving space for the primary receptor binding to domain III of E. The use of carbohydrate moieties for receptor binding sites suggests a mechanism for avoiding immune surveillance. 履歴 登録 2005年9月30日 登録サイト / 処理サイト 改定 1.0 2006年3月7日 Provider / タイプ 改定 1.1 2008年5月1日 Group 改定 1.2 2011年7月13日 Group 改定 1.3 2018年7月18日 Group / カテゴリ / em_software / Item / _em_software.name改定 1.4 2024年2月14日 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / em_3d_fitting_list / pdbx_initial_refinement_model / pdbx_struct_oper_list / struct_ref_seq_dif Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _em_3d_fitting_list.accession_code / _em_3d_fitting_list.initial_refinement_model_id / _em_3d_fitting_list.source_name / _em_3d_fitting_list.type / _pdbx_struct_oper_list.name / _pdbx_struct_oper_list.symmetry_operation / _pdbx_struct_oper_list.type / _struct_ref_seq_dif.details
すべて表示 表示を減らす Remark 999 SEQUENCE The proteins in this entry contain CA only.
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 cell-cell recognition / peptide antigen transport / modulation by virus of host process / intracellular transport of virus / Butyrophilin (BTN) family interactions / positive regulation of viral life cycle /
cell-cell recognition / peptide antigen transport / modulation by virus of host process / intracellular transport of virus / Butyrophilin (BTN) family interactions / positive regulation of viral life cycle /  宿主 /
宿主 /  virion binding / heterophilic cell-cell adhesion via plasma membrane cell adhesion molecules ...B cell adhesion /
virion binding / heterophilic cell-cell adhesion via plasma membrane cell adhesion molecules ...B cell adhesion /  cell-cell recognition / peptide antigen transport / modulation by virus of host process / intracellular transport of virus / Butyrophilin (BTN) family interactions / positive regulation of viral life cycle /
cell-cell recognition / peptide antigen transport / modulation by virus of host process / intracellular transport of virus / Butyrophilin (BTN) family interactions / positive regulation of viral life cycle /  宿主 /
宿主 /  virion binding / heterophilic cell-cell adhesion via plasma membrane cell adhesion molecules / leukocyte cell-cell adhesion / regulation of T cell proliferation / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of host TYK2 activity / stimulatory C-type lectin receptor signaling pathway /
virion binding / heterophilic cell-cell adhesion via plasma membrane cell adhesion molecules / leukocyte cell-cell adhesion / regulation of T cell proliferation / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of host TYK2 activity / stimulatory C-type lectin receptor signaling pathway /  mannose binding / host cell mitochondrion / antigen processing and presentation / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / positive regulation of T cell proliferation / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / CD209 (DC-SIGN) signaling / ribonucleoside triphosphate phosphatase activity / viral genome replication /
mannose binding / host cell mitochondrion / antigen processing and presentation / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / positive regulation of T cell proliferation / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / CD209 (DC-SIGN) signaling / ribonucleoside triphosphate phosphatase activity / viral genome replication /  エンドサイトーシス / peptide antigen binding /
エンドサイトーシス / peptide antigen binding /  カプシド /
カプシド /  : /
: /  double-stranded RNA binding / virus receptor activity / protein complex oligomerization / monoatomic ion channel activity /
double-stranded RNA binding / virus receptor activity / protein complex oligomerization / monoatomic ion channel activity /  carbohydrate binding / clathrin-dependent endocytosis of virus by host cell /
carbohydrate binding / clathrin-dependent endocytosis of virus by host cell /  mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity /
mRNA (nucleoside-2'-O-)-methyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity /  RNA helicase activity /
RNA helicase activity /  獲得免疫系 / membrane => GO:0016020 / host cell endoplasmic reticulum membrane /
獲得免疫系 / membrane => GO:0016020 / host cell endoplasmic reticulum membrane /  protein dimerization activity / intracellular signal transduction /
protein dimerization activity / intracellular signal transduction /  免疫応答 / induction by virus of host autophagy / symbiont entry into host cell / viral RNA genome replication / external side of plasma membrane /
免疫応答 / induction by virus of host autophagy / symbiont entry into host cell / viral RNA genome replication / external side of plasma membrane /  RNA-dependent RNA polymerase activity / serine-type endopeptidase activity /
RNA-dependent RNA polymerase activity / serine-type endopeptidase activity /  自然免疫系 / fusion of virus membrane with host endosome membrane /
自然免疫系 / fusion of virus membrane with host endosome membrane /  エンベロープ (ウイルス) / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / host cell nucleus / virion attachment to host cell / virion membrane / structural molecule activity /
エンベロープ (ウイルス) / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / host cell nucleus / virion attachment to host cell / virion membrane / structural molecule activity /  細胞膜 /
細胞膜 /  タンパク質分解 / extracellular region /
タンパク質分解 / extracellular region /  ATP binding /
ATP binding /  生体膜 /
生体膜 /  metal ion binding /
metal ion binding /  細胞膜 /
細胞膜 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト)

 Dengue virus (デング熱ウイルス)
Dengue virus (デング熱ウイルス) 電子顕微鏡法 /
電子顕微鏡法 /  単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 25 Å
クライオ電子顕微鏡法 / 解像度: 25 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Cell / 年: 2006
ジャーナル: Cell / 年: 2006
 構造の表示
構造の表示 ムービービューア
ムービービューア Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2b6b.cif.gz
2b6b.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2b6b.ent.gz
pdb2b6b.ent.gz PDB形式
PDB形式 2b6b.json.gz
2b6b.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/b6/2b6b
https://data.pdbj.org/pub/pdb/validation_reports/b6/2b6b ftp://data.pdbj.org/pub/pdb/validation_reports/b6/2b6b
ftp://data.pdbj.org/pub/pdb/validation_reports/b6/2b6b リンク
リンク 集合体
集合体




 : 532 / シェーンフリース記号
: 532 / シェーンフリース記号 : I (正20面体型対称
: I (正20面体型対称 ))
)) 要素
要素

 Dengue virus (デング熱ウイルス) / 属: Flavivirus
Dengue virus (デング熱ウイルス) / 属: Flavivirus / 参照:
/ 参照:  GenBank: 323503, UniProt: Q9WDA7*PLUS
GenBank: 323503, UniProt: Q9WDA7*PLUS
 Homo sapiens (ヒト) / 遺伝子: CD209 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: CD209 / 発現宿主: 
 Escherichia coli (大腸菌) / 参照: UniProt: Q96QQ4, UniProt: Q9NNX6*PLUS
Escherichia coli (大腸菌) / 参照: UniProt: Q96QQ4, UniProt: Q9NNX6*PLUS 電子顕微鏡法
電子顕微鏡法 単粒子再構成法
単粒子再構成法 試料調製
試料調製 : NO / 凍結
: NO / 凍結 : YES
: YES
 電子顕微鏡撮影
電子顕微鏡撮影 :
:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM
FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1100 nm / Cs
Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1100 nm / Cs : 2 mm
: 2 mm 解析
解析
 : I (正20面体型対称
: I (正20面体型対称 )
)
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj