+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1qcq | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
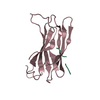
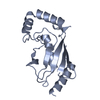
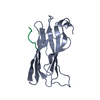
| タイトル | UBIQUITIN CONJUGATING ENZYME | |||||||||
 要素 要素 | PROTEIN (UBIQUITIN CONJUGATING ENZYME) | |||||||||
 キーワード キーワード |  LIGASE (リガーゼ) / LIGASE (リガーゼ) /  UBIQUITIN (ユビキチン) / UBIQUITIN (ユビキチン) /  UBIQUITIN-CONJUGATING ENZYME (ユビキチン結合酵素) / UBIQUITIN-CONJUGATING ENZYME (ユビキチン結合酵素) /  YEAST (酵母) YEAST (酵母) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 Peroxisomal protein import / Peroxisomal protein import /  cytoplasm protein quality control by the ubiquitin-proteasome system / mitochondria-associated ubiquitin-dependent protein catabolic process / ubiquitin-dependent protein catabolic process via the multivesicular body sorting pathway / ribosome-associated ubiquitin-dependent protein catabolic process / cytoplasm protein quality control by the ubiquitin-proteasome system / mitochondria-associated ubiquitin-dependent protein catabolic process / ubiquitin-dependent protein catabolic process via the multivesicular body sorting pathway / ribosome-associated ubiquitin-dependent protein catabolic process /  ユビキチン結合酵素 / ユビキチン結合酵素 /  proteasome binding / ubiquitin conjugating enzyme activity / protein monoubiquitination / rescue of stalled ribosome ... proteasome binding / ubiquitin conjugating enzyme activity / protein monoubiquitination / rescue of stalled ribosome ... Peroxisomal protein import / Peroxisomal protein import /  cytoplasm protein quality control by the ubiquitin-proteasome system / mitochondria-associated ubiquitin-dependent protein catabolic process / ubiquitin-dependent protein catabolic process via the multivesicular body sorting pathway / ribosome-associated ubiquitin-dependent protein catabolic process / cytoplasm protein quality control by the ubiquitin-proteasome system / mitochondria-associated ubiquitin-dependent protein catabolic process / ubiquitin-dependent protein catabolic process via the multivesicular body sorting pathway / ribosome-associated ubiquitin-dependent protein catabolic process /  ユビキチン結合酵素 / ユビキチン結合酵素 /  proteasome binding / ubiquitin conjugating enzyme activity / protein monoubiquitination / rescue of stalled ribosome / proteasome binding / ubiquitin conjugating enzyme activity / protein monoubiquitination / rescue of stalled ribosome /  ubiquitin ligase complex / ubiquitin ligase complex /  ubiquitin binding / protein polyubiquitination / ubiquitin-protein transferase activity / protein-macromolecule adaptor activity / ubiquitin-dependent protein catabolic process / protein ubiquitination / ubiquitin binding / protein polyubiquitination / ubiquitin-protein transferase activity / protein-macromolecule adaptor activity / ubiquitin-dependent protein catabolic process / protein ubiquitination /  ubiquitin protein ligase binding / ubiquitin protein ligase binding /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | |||||||||
| 手法 |  X線回折 / 解像度: 2.7 Å X線回折 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Cook, W.J. / Jeffrey, L.C. / Xu, Y. / Chau, V. | |||||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1993 ジャーナル: Biochemistry / 年: 1993タイトル: Tertiary structures of class I ubiquitin-conjugating enzymes are highly conserved: crystal structure of yeast Ubc4. 著者: Cook, W.J. / Jeffrey, L.C. / Xu, Y. / Chau, V. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1qcq.cif.gz 1qcq.cif.gz | 39.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1qcq.ent.gz pdb1qcq.ent.gz | 27.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1qcq.json.gz 1qcq.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qc/1qcq https://data.pdbj.org/pub/pdb/validation_reports/qc/1qcq ftp://data.pdbj.org/pub/pdb/validation_reports/qc/1qcq ftp://data.pdbj.org/pub/pdb/validation_reports/qc/1qcq | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 16474.715 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: P15731, Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: P15731,  ユビキチンリガーゼ ユビキチンリガーゼ |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 4 X線回折 / 使用した結晶の数: 4 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.11 Å3/Da / 溶媒含有率: 60.51 % | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.8 詳細: PEG 8000, MAGNESIUM ACETATE, CACODYLATE, pH 5.8, VAPOR DIFFUSION, HANGING DROP | |||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法 | |||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 | ||||||||||||||||||||
| 検出器 |
| ||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 | ||||||||||||||||||||
| 反射 | 解像度: 2.7→100 Å / Num. obs: 5940 / % possible obs: 97 % / Observed criterion σ(I): 0 / 冗長度: 3.8 % / Biso Wilson estimate: 37.5 Å2 / Rmerge(I) obs: 0.134 / Net I/σ(I): 10.2 | ||||||||||||||||||||
| 反射 シェル | 解像度: 2.7→2.87 Å / 冗長度: 2.2 % / Rmerge(I) obs: 0.368 / % possible all: 87 | ||||||||||||||||||||
| 反射 | *PLUS Num. measured all: 22434 | ||||||||||||||||||||
| 反射 シェル | *PLUS % possible obs: 87 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2.7→100 Å / Rfactor Rfree error: 0.016 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: ENGH & HUBER
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 25.84 Å2 / ksol: 0.31 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 24 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.7→100 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.7→2.87 Å / Rfactor Rfree error: 0.049 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file | Serial no: 1 / Param file: PROTEIN_REP.PA / Topol file: PROTEIN.TOP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: CNS / バージョン: 0.4 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj


