+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1knf | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal Structure of 2,3-dihydroxybiphenyl 1,2-dioxygenase Complexed with 3-methyl Catechol under Anaerobic Condition | ||||||
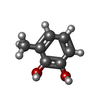
 要素 要素 | 2,3-DIHYDROXYBIPHENYL 1,2-DIOXYGENASE | ||||||
 キーワード キーワード |  OXIDOREDUCTASE (酸化還元酵素) / OXIDOREDUCTASE (酸化還元酵素) /  dioxygenase / 2 / 3-dihydroxybiphenyl / 3-methyl catechol dioxygenase / 2 / 3-dihydroxybiphenyl / 3-methyl catechol | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 ビフェニル-2,3-ジオール-1,2-ジオキシゲナーゼ / ビフェニル-2,3-ジオール-1,2-ジオキシゲナーゼ /  biphenyl-2,3-diol 1,2-dioxygenase activity / : / xenobiotic catabolic process / biphenyl-2,3-diol 1,2-dioxygenase activity / : / xenobiotic catabolic process /  ferrous iron binding ferrous iron binding類似検索 - 分子機能 | ||||||
| 生物種 |   Burkholderia xenovorans (バクテリア) Burkholderia xenovorans (バクテリア) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.9 Å 分子置換 / 解像度: 1.9 Å | ||||||
 データ登録者 データ登録者 | Han, S. / Bolin, J.T. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 1998 ジャーナル: J.Biol.Chem. / 年: 1998タイトル: Molecular basis for the stabilization and inhibition of 2, 3-dihydroxybiphenyl 1,2-dioxygenase by t-butanol. 著者: Vaillancourt, F.H. / Han, S. / Fortin, P.D. / Bolin, J.T. / Eltis, L.D. #1:  ジャーナル: Science / 年: 1995 ジャーナル: Science / 年: 1995タイトル: Crystal Structure of the Biphenyl-cleaving Extradiol Dioxygenase from a PCB-degrading Pseudomonad. 著者: Han, S. / Eltis, L.D. / Timmis, K.N. / Muchmore, S.W. / Bolin, J.T. #2:  ジャーナル: Handbook of Metalloproteins / 年: 2001 ジャーナル: Handbook of Metalloproteins / 年: 2001タイトル: 2,3-Dihydroxybiphenyl 1,2-dioxygenase. 著者: Bolin, J.T. / Eltis, L.D. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1knf.cif.gz 1knf.cif.gz | 74.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1knf.ent.gz pdb1knf.ent.gz | 53.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1knf.json.gz 1knf.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/kn/1knf https://data.pdbj.org/pub/pdb/validation_reports/kn/1knf ftp://data.pdbj.org/pub/pdb/validation_reports/kn/1knf ftp://data.pdbj.org/pub/pdb/validation_reports/kn/1knf | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | x 8
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | The biological assembly is homo-octamer generated by crystallographic symmetry |
- 要素
要素
| #1: タンパク質 | 分子量: 32377.598 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)   Burkholderia xenovorans (バクテリア) Burkholderia xenovorans (バクテリア)株: LB400 解説: HYPEREXPRESSED IN THE PARENT STRAIN (This organism has been reclassified. Prior publications may refer to this source as Pseudomonas sp. strain LB400.) 遺伝子: BPHC / プラスミド: PLEBD4 / 発現宿主:   Burkholderia cepacia (バクテリア) Burkholderia cepacia (バクテリア)参照: UniProt: P47228,  ビフェニル-2,3-ジオール-1,2-ジオキシゲナーゼ ビフェニル-2,3-ジオール-1,2-ジオキシゲナーゼ | ||||||
|---|---|---|---|---|---|---|---|
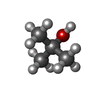
| #2: 化合物 | | #3: 化合物 | ChemComp-MBD / |  3-Methylcatechol 3-Methylcatechol#4: 化合物 |  Tert-ブチルアルコール Tert-ブチルアルコール#5: 水 | ChemComp-HOH / |  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.22 Å3/Da / 溶媒含有率: 62 % |
|---|---|
結晶化 | 温度: 278 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.5 詳細: PEG4000, t-butanol, 3-methyl catechol, pH 7.5, VAPOR DIFFUSION, SITTING DROP, temperature 278K |
-データ収集
| 回折 | 平均測定温度: 298 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 Å |
| 検出器 | タイプ: RIGAKU RAXIS II / 検出器: IMAGE PLATE / 日付: 1995年11月30日 / 詳細: mirrors |
| 放射 | モノクロメーター: YALE MIRRORS / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.9→40 Å / Num. all: 32641 / Num. obs: 32641 / % possible obs: 97 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 6.9 % / Rsym value: 0.08 / Net I/σ(I): 44.8 |
| 反射 シェル | 解像度: 1.9→1.97 Å / 冗長度: 3.8 % / Mean I/σ(I) obs: 5.1 / Num. unique all: 2397 / Rsym value: 0.27 / % possible all: 73.1 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 1HAN 解像度: 1.9→7 Å / 交差検証法: THROUGHOUT / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber 詳細: ALL FE-PROTEIN BOND DISTANCES WERE HARMONICALLY RESTRAINED TO AN EQUILIBRIUM DISTANCE OF 2.2 ANGSTROMS USING A WEAK FORCE CONSTANT OF 10 KCAL/(MOLE X ANGSTROM-SQUARED). BOND LENGTH, BOND ...詳細: ALL FE-PROTEIN BOND DISTANCES WERE HARMONICALLY RESTRAINED TO AN EQUILIBRIUM DISTANCE OF 2.2 ANGSTROMS USING A WEAK FORCE CONSTANT OF 10 KCAL/(MOLE X ANGSTROM-SQUARED). BOND LENGTH, BOND ANGLE, AND PLANARITY RESTRAINTS SIMILAR TO THOSE USED FOR AROMATIC SIDE CHAINS WERE APPLIED TO HET GROUP CAQ (CATECHOL). FE-CAQ AND FE-WATER BOND DISTANCES WERE NOT RESTRAINED. THE REFINED MODEL INCLUDES TWO MUTALLY EXCLUSIVE STRUCTURES IN THE VICINITY OF THE ACTIVE SITE. STRUCTURE ONE (labeled with alternate conformation marker A) INCLUDES A SUBSTRATE 3-METHYL-CATECHOL (MBD 301) AND WATERS 9001 and 9002 AT 50% OCCUPANCY. ATOMS OA1 AND OA2 OF MBD 301 AND WATER 9001 ARE COORDINATED TO FE2 500. STRUCTURE TWO (labeled with alternate conformation marker B) INCLUDES ONE MOLECULE OF T-BUTANOL (TBU 600) AND WATERS 3001, 3012, AND 4014 AT 50% OCCUPANCY, AND IS EQUIVALENT TO THE SUBSTRATE-FREE STRUCTURE WHERE WATERS 3001 AND 3012 ARE COORDINATED TO FE2 500.
| ||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 24.3 Å2 | ||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.9→7 Å
| ||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.9→1.93 Å
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj