+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1jrs | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | HEMIACETAL COMPLEX BETWEEN LEUPEPTIN AND TRYPSIN | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR /  HYDROLASE (加水分解酵素) / HYDROLASE (加水分解酵素) /  SERINE PROTEASE (セリンプロテアーゼ) / SERINE PROTEASE (セリンプロテアーゼ) /  DIGESTION (消化) / DIGESTION (消化) /  PANCREAS (膵臓) / PANCREAS (膵臓) /  ZYMOGEN (酵素前駆体) / HYDROLASE (SERINE PROTEASE) / HYDROLASE-HYDROLASE INHIBITOR COMPLEX ZYMOGEN (酵素前駆体) / HYDROLASE (SERINE PROTEASE) / HYDROLASE-HYDROLASE INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 トリプシン / トリプシン /  serpin family protein binding / serpin family protein binding /  serine protease inhibitor complex / serine protease inhibitor complex /  消化 / 消化 /  endopeptidase activity / serine-type endopeptidase activity / endopeptidase activity / serine-type endopeptidase activity /  タンパク質分解 / タンパク質分解 /  extracellular space / extracellular space /  metal ion binding metal ion binding類似検索 - 分子機能 | ||||||
| 生物種 |   Bos taurus (ウシ) Bos taurus (ウシ) Actinomycetes Streptomyces roseus MA 839-A1 (バクテリア) Actinomycetes Streptomyces roseus MA 839-A1 (バクテリア) | ||||||
| 手法 |  X線回折 / 解像度: 1.8 Å X線回折 / 解像度: 1.8 Å | ||||||
 データ登録者 データ登録者 | Kurinov, I.V. / Harrison, R.W. | ||||||
 引用 引用 |  ジャーナル: Protein Sci. / 年: 1996 ジャーナル: Protein Sci. / 年: 1996タイトル: Two crystal structures of the leupeptin-trypsin complex. 著者: Kurinov, I.V. / Harrison, R.W. #1:  ジャーナル: Nat.Struct.Biol. / 年: 1994 ジャーナル: Nat.Struct.Biol. / 年: 1994タイトル: Prediction of New Serine Proteinase Inhibitors 著者: Kurinov, I.V. / Harrison, R.W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1jrs.cif.gz 1jrs.cif.gz | 69.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1jrs.ent.gz pdb1jrs.ent.gz | 55.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1jrs.json.gz 1jrs.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/jr/1jrs https://data.pdbj.org/pub/pdb/validation_reports/jr/1jrs ftp://data.pdbj.org/pub/pdb/validation_reports/jr/1jrs ftp://data.pdbj.org/pub/pdb/validation_reports/jr/1jrs | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 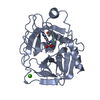
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 |  トリプシン トリプシン分子量: 23324.287 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Bos taurus (ウシ) / 参照: UniProt: P00760, Bos taurus (ウシ) / 参照: UniProt: P00760,  トリプシン トリプシン | ||
|---|---|---|---|
| #2: タンパク質・ペプチド |  ロイペプチン / ロイペプチン /  ロイペプチン ロイペプチン | ||
| #3: 化合物 | ChemComp-CA / | ||
| #4: 水 | ChemComp-HOH /  水 水 | ||
| 構成要素の詳細 | THE LEUPEPTIN IS COVALENTLY| 配列の詳細 | THERE IS A DISCREPANCY IN THE NORINE AND PDB NUMBERING, AS NORINE COUNTS ACE AND LEU TOGETHER AS ...THERE IS A DISCREPANC | |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.93 Å3/Da / 溶媒含有率: 56 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | 手法: 蒸気拡散法, ハンギングドロップ法 詳細: ORTHORHOMBIC SPACE GROUP; CRYSTALLIZATION CONDITIONS: 24-26% PEG8000, 0.02M INHIBITOR, 0.2M (NH4)2 SO4, 50MM TRIS-HCL, ROOM TEMPERATURE, HANGING DROP., vapor diffusion - hanging drop Temp details: room temp | ||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 8 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 波長: 1.5418 |
|---|---|
| 検出器 | タイプ: RIGAKU / 検出器: IMAGE PLATE / 日付: 1994年3月19日 |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 |
| 反射 | Num. obs: 78707 / % possible obs: 88.8 % / Observed criterion σ(I): 1 / 冗長度: 3.24 % / Rmerge(I) obs: 0.044 |
| 反射 | *PLUS 最高解像度: 1.8 Å |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.8→8 Å / σ(F): 2 /
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 22.2 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / 分類: refinement X-PLOR / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS |
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj