+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1beh | ||||||
|---|---|---|---|---|---|---|---|
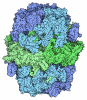
| タイトル | HUMAN PHOSPHATIDYLETHANOLAMINE BINDING PROTEIN IN COMPLEX WITH CACODYLATE | ||||||
 要素 要素 | PHOSPHATIDYLETHANOLAMINE BINDING PROTEIN | ||||||
 キーワード キーワード | LIPID BINDING PROTEIN / LIPID-BINDING /  SIGNALLING SIGNALLING | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 phosphatidylethanolamine binding / negative regulation of MAPK cascade / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / serine-type endopeptidase inhibitor activity / Negative regulation of MAPK pathway / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions ... phosphatidylethanolamine binding / negative regulation of MAPK cascade / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / serine-type endopeptidase inhibitor activity / Negative regulation of MAPK pathway / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions ... phosphatidylethanolamine binding / negative regulation of MAPK cascade / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / serine-type endopeptidase inhibitor activity / Negative regulation of MAPK pathway / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions / phosphatidylethanolamine binding / negative regulation of MAPK cascade / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / serine-type endopeptidase inhibitor activity / Negative regulation of MAPK pathway / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions /  protein kinase binding / protein kinase binding /  enzyme binding / enzyme binding /  RNA binding / extracellular exosome / RNA binding / extracellular exosome /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.75 Å 分子置換 / 解像度: 1.75 Å | ||||||
 データ登録者 データ登録者 | Banfield, M.J. / Barker, J.J. / Perry, A. / Brady, R.L. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 1998 ジャーナル: Structure / 年: 1998タイトル: Function from structure? The crystal structure of human phosphatidylethanolamine-binding protein suggests a role in membrane signal transduction. 著者: Banfield, M.J. / Barker, J.J. / Perry, A.C. / Brady, R.L. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1beh.cif.gz 1beh.cif.gz | 84.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1beh.ent.gz pdb1beh.ent.gz | 67.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1beh.json.gz 1beh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/be/1beh https://data.pdbj.org/pub/pdb/validation_reports/be/1beh ftp://data.pdbj.org/pub/pdb/validation_reports/be/1beh ftp://data.pdbj.org/pub/pdb/validation_reports/be/1beh | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.48316, 0.87203, -0.07827), ベクター  : : |
- 要素
要素
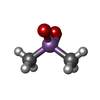
| #1: タンパク質 | 分子量: 21086.787 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 細胞内の位置: CYTOPLASM, MEMBRANE-ASSOCIATED Homo sapiens (ヒト) / 細胞内の位置: CYTOPLASM, MEMBRANE-ASSOCIATED 細胞質 / プラスミド: PET-15B / 生物種 (発現宿主): Escherichia coli / 細胞内の位置 (発現宿主): CYTOPLASM / 発現宿主: 細胞質 / プラスミド: PET-15B / 生物種 (発現宿主): Escherichia coli / 細胞内の位置 (発現宿主): CYTOPLASM / 発現宿主:   Escherichia coli BL21 (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P30086 Escherichia coli BL21 (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P30086#2: 化合物 |  カコジル酸 カコジル酸#3: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.2 Å3/Da / 溶媒含有率: 36 % | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | pH: 6.5 詳細: PROTEIN WAS CRYSTALLIZED FROM 28-32% PEG 4000/6000/8000, 200-300 MM SODIUM ACETATE, 100MM SODIUM CACODYLATE., pH 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: unknown | ||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SRS SRS  / ビームライン: PX7.2 / 波長: 1.488 / ビームライン: PX7.2 / 波長: 1.488 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1997年4月15日 / 詳細: MIRRORS |
| 放射 | モノクロメーター: GE(111) / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.488 Å / 相対比: 1 : 1.488 Å / 相対比: 1 |
| 反射 | 解像度: 1.7→20 Å / Num. obs: 38803 / % possible obs: 95.6 % / Observed criterion σ(I): -3 / 冗長度: 2.4 % / Biso Wilson estimate: 19.1 Å2 / Rmerge(I) obs: 0.055 / Net I/σ(I): 16.2 |
| 反射 シェル | 解像度: 1.7→1.76 Å / 冗長度: 2.3 % / Rmerge(I) obs: 0.28 / Mean I/σ(I) obs: 2.6 / % possible all: 94.9 |
| 反射 シェル | *PLUS % possible obs: 94.9 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: PDB ENTRY 1BD9 解像度: 1.75→20 Å / 交差検証法: THROUGHOUT / σ(F): 0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 24 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.75→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: REFMAC / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor obs: 0.235 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS 最高解像度: 1.75 Å / 最低解像度: 1.83 Å / Rfactor all: 0.268 / Rfactor obs: 0.322 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj