+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of human PI3K-alpha (P85/P110-H1047R) with QR-8557 binding at an allosteric site | |||||||||
 マップデータ マップデータ | CryoEM density map of human PI3K-alpha (P85/P110-H1047R) with Cpd2 binding at an unidentified allosteric site | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | PI3K-alpha /  lipid kinase (キナーゼ) / lipid kinase (キナーゼ) /  allosteric inhibition (アロステリック効果) / allosteric inhibition (アロステリック効果) /  ONCOPROTEIN (がん遺伝子) ONCOPROTEIN (がん遺伝子) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報perinuclear endoplasmic reticulum membrane / response to muscle inactivity / negative regulation of actin filament depolymerization / regulation of toll-like receptor 4 signaling pathway / response to L-leucine / phosphatidylinositol kinase activity / regulation of actin filament organization / phosphatidylinositol 3-kinase regulator activity / response to butyrate / autosome genomic imprinting ...perinuclear endoplasmic reticulum membrane / response to muscle inactivity / negative regulation of actin filament depolymerization / regulation of toll-like receptor 4 signaling pathway / response to L-leucine / phosphatidylinositol kinase activity / regulation of actin filament organization / phosphatidylinositol 3-kinase regulator activity / response to butyrate / autosome genomic imprinting / positive regulation of focal adhesion disassembly / IRS-mediated signalling / cellular response to hydrostatic pressure / phosphatidylinositol 3-kinase activator activity / interleukin-18-mediated signaling pathway / PI3K events in ERBB4 signaling / myeloid leukocyte migration / phosphatidylinositol 3-kinase regulatory subunit binding / 1-phosphatidylinositol-3-kinase regulator activity / neurotrophin TRKA receptor binding / Activated NTRK2 signals through PI3K / positive regulation of protein localization to membrane / cis-Golgi network / Activated NTRK3 signals through PI3K / kinase activator activity / ErbB-3 class receptor binding / negative regulation of fibroblast apoptotic process / RHOF GTPase cycle / cardiac muscle cell contraction / phosphatidylinositol 3-kinase complex, class IB / vasculature development /  transmembrane receptor protein tyrosine kinase adaptor activity / RHOD GTPase cycle / positive regulation of endoplasmic reticulum unfolded protein response / Signaling by cytosolic FGFR1 fusion mutants / transmembrane receptor protein tyrosine kinase adaptor activity / RHOD GTPase cycle / positive regulation of endoplasmic reticulum unfolded protein response / Signaling by cytosolic FGFR1 fusion mutants /  regulation of cellular respiration / enzyme-substrate adaptor activity / regulation of cellular respiration / enzyme-substrate adaptor activity /  phosphatidylinositol 3-kinase complex / phosphatidylinositol 3-kinase complex /  anoikis / Nephrin family interactions / 1-phosphatidylinositol-4-phosphate 3-kinase activity / RND1 GTPase cycle / Costimulation by the CD28 family / vascular endothelial growth factor signaling pathway / 1-phosphatidylinositol-4,5-bisphosphate 3-kinase activity / RND2 GTPase cycle / MET activates PI3K/AKT signaling / PI3K/AKT activation / RND3 GTPase cycle / positive regulation of leukocyte migration / anoikis / Nephrin family interactions / 1-phosphatidylinositol-4-phosphate 3-kinase activity / RND1 GTPase cycle / Costimulation by the CD28 family / vascular endothelial growth factor signaling pathway / 1-phosphatidylinositol-4,5-bisphosphate 3-kinase activity / RND2 GTPase cycle / MET activates PI3K/AKT signaling / PI3K/AKT activation / RND3 GTPase cycle / positive regulation of leukocyte migration /  phosphatidylinositol-4,5-bisphosphate 3-kinase / positive regulation of filopodium assembly / phosphatidylinositol 3-kinase complex, class IA / negative regulation of stress fiber assembly / phosphatidylinositol-4,5-bisphosphate 3-kinase / positive regulation of filopodium assembly / phosphatidylinositol 3-kinase complex, class IA / negative regulation of stress fiber assembly /  PI3キナーゼ / relaxation of cardiac muscle / growth hormone receptor signaling pathway / phosphatidylinositol-3-phosphate biosynthetic process / PI3キナーゼ / relaxation of cardiac muscle / growth hormone receptor signaling pathway / phosphatidylinositol-3-phosphate biosynthetic process /  insulin binding / 1-phosphatidylinositol-3-kinase activity / RHOV GTPase cycle / negative regulation of macroautophagy / RHOB GTPase cycle / Signaling by ALK / negative regulation of cell-matrix adhesion / GP1b-IX-V activation signalling / PI-3K cascade:FGFR3 / Erythropoietin activates Phosphoinositide-3-kinase (PI3K) / protein kinase activator activity / response to dexamethasone / PI-3K cascade:FGFR2 / PI-3K cascade:FGFR4 / RHOJ GTPase cycle / RHOC GTPase cycle / PI-3K cascade:FGFR1 / negative regulation of osteoclast differentiation / intracellular glucose homeostasis / CD28 dependent PI3K/Akt signaling / Synthesis of PIPs at the plasma membrane / phosphatidylinositol phosphate biosynthetic process / CDC42 GTPase cycle / RHOU GTPase cycle / PI3K events in ERBB2 signaling / Signaling by ALK fusions and activated point mutants / RHOG GTPase cycle / negative regulation of anoikis / RET signaling / T cell differentiation / regulation of multicellular organism growth / extrinsic apoptotic signaling pathway via death domain receptors / insulin binding / 1-phosphatidylinositol-3-kinase activity / RHOV GTPase cycle / negative regulation of macroautophagy / RHOB GTPase cycle / Signaling by ALK / negative regulation of cell-matrix adhesion / GP1b-IX-V activation signalling / PI-3K cascade:FGFR3 / Erythropoietin activates Phosphoinositide-3-kinase (PI3K) / protein kinase activator activity / response to dexamethasone / PI-3K cascade:FGFR2 / PI-3K cascade:FGFR4 / RHOJ GTPase cycle / RHOC GTPase cycle / PI-3K cascade:FGFR1 / negative regulation of osteoclast differentiation / intracellular glucose homeostasis / CD28 dependent PI3K/Akt signaling / Synthesis of PIPs at the plasma membrane / phosphatidylinositol phosphate biosynthetic process / CDC42 GTPase cycle / RHOU GTPase cycle / PI3K events in ERBB2 signaling / Signaling by ALK fusions and activated point mutants / RHOG GTPase cycle / negative regulation of anoikis / RET signaling / T cell differentiation / regulation of multicellular organism growth / extrinsic apoptotic signaling pathway via death domain receptors /  insulin receptor substrate binding / insulin receptor substrate binding /  Interleukin-3, Interleukin-5 and GM-CSF signaling / PI3K Cascade / Interleukin-3, Interleukin-5 and GM-CSF signaling / PI3K Cascade /  介在板 / RHOA GTPase cycle / positive regulation of TOR signaling / endothelial cell migration / RAC2 GTPase cycle / RAC3 GTPase cycle / GAB1 signalosome 介在板 / RHOA GTPase cycle / positive regulation of TOR signaling / endothelial cell migration / RAC2 GTPase cycle / RAC3 GTPase cycle / GAB1 signalosome類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
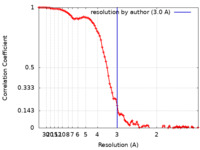
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.0 Å クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Huang X / Ren X / Zhong W | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2024 ジャーナル: Structure / 年: 2024タイトル: Cryo-EM structures reveal two allosteric inhibition modes of PI3Kα involving a re-shaping of the activation loop. 著者: Xiuliang Huang / Kailiang Wang / Jing Han / Xiumei Chen / Zhenglin Wang / Tianlun Wu / Bo Yu / Feng Zhao / Xinjuan Wang / Huijuan Li / Zhi Xie / Xiaotian Zhu / Wenge Zhong / Xiaoming Ren /   要旨: PI3Kα is a lipid kinase that phosphorylates PIP2 and generates PIP3. The hyperactive PI3Kα mutation, H1047R, accounts for about 14% of breast cancer, making it a highly attractive target for drug ...PI3Kα is a lipid kinase that phosphorylates PIP2 and generates PIP3. The hyperactive PI3Kα mutation, H1047R, accounts for about 14% of breast cancer, making it a highly attractive target for drug discovery. Here, we report the cryo-EM structures of PI3Kα bound to two different allosteric inhibitors QR-7909 and QR-8557 at a global resolution of 2.7 Å and 3.0 Å, respectively. The structures reveal two distinct binding pockets on the opposite sides of the activation loop. Structural and MD simulation analyses show that the allosteric binding of QR-7909 and QR-8557 inhibit PI3Kα hyper-activity by reducing the fluctuation and mobility of the activation loop. Our work provides a strong rational basis for a further optimization and development of highly selective drug candidates to treat PI3Kα-driven cancers. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
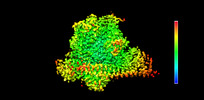
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37363.map.gz emd_37363.map.gz | 59.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37363-v30.xml emd-37363-v30.xml emd-37363.xml emd-37363.xml | 16.7 KB 16.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_37363_fsc.xml emd_37363_fsc.xml | 10.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_37363.png emd_37363.png | 45.4 KB | ||
| Filedesc metadata |  emd-37363.cif.gz emd-37363.cif.gz | 6.3 KB | ||
| その他 |  emd_37363_half_map_1.map.gz emd_37363_half_map_1.map.gz emd_37363_half_map_2.map.gz emd_37363_half_map_2.map.gz | 49.7 MB 49.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37363 http://ftp.pdbj.org/pub/emdb/structures/EMD-37363 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37363 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37363 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8w9bMC  8w9aC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37363.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37363.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM density map of human PI3K-alpha (P85/P110-H1047R) with Cpd2 binding at an unidentified allosteric site | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.74 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map 1 of Cpd2-bound human PI3K-alpha (P85/P110-H1047R)
| ファイル | emd_37363_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 of Cpd2-bound human PI3K-alpha (P85/P110-H1047R) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
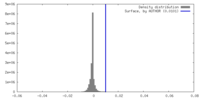
| 密度ヒストグラム |
-ハーフマップ: Half map 2 of Cpd2-bound human PI3K-alpha (P85/P110-H1047R)
| ファイル | emd_37363_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 of Cpd2-bound human PI3K-alpha (P85/P110-H1047R) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
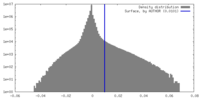
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human PI3K-alpha (P85/P110-H1047R) with QR-8557 binding at an all...
| 全体 | 名称: human PI3K-alpha (P85/P110-H1047R) with QR-8557 binding at an allosteric site |
|---|---|
| 要素 |
|
-超分子 #1: human PI3K-alpha (P85/P110-H1047R) with QR-8557 binding at an all...
| 超分子 | 名称: human PI3K-alpha (P85/P110-H1047R) with QR-8557 binding at an allosteric site タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit ...
| 分子 | 名称: Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号:  PI3キナーゼ PI3キナーゼ |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 124.23075 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MPPRPSSGEL WGIHLMPPRI LVECLLPNGM IVTLECLREA TLITIKHELF KEARKYPLHQ LLQDESSYIF VSVTQEAERE EFFDETRRL CDLRLFQPFL KVIEPVGNRE EKILNREIGF AIGMPVCEFD MVKDPEVQDF RRNILNVCKE AVDLRDLNSP H SRAMYVYP ...文字列: MPPRPSSGEL WGIHLMPPRI LVECLLPNGM IVTLECLREA TLITIKHELF KEARKYPLHQ LLQDESSYIF VSVTQEAERE EFFDETRRL CDLRLFQPFL KVIEPVGNRE EKILNREIGF AIGMPVCEFD MVKDPEVQDF RRNILNVCKE AVDLRDLNSP H SRAMYVYP PNVESSPELP KHIYNKLDKG QIIVVIWVIV SPNNDKQKYT LKINHDCVPE QVIAEAIRKK TRSMLLSSEQ LK LCVLEYQ GKYILKVCGC DEYFLEKYPL SQYKYIRSCI MLGRMPNLML MAKESLYSQL PMDCFTMPSY SRRISTATPY MNG ETSTKS LWVINSALRI KILCATYVNV NIRDIDKIYV RTGIYHGGEP LCDNVNTQRV PCSNPRWNEW LNYDIYIPDL PRAA RLCLS ICSVKGRKGA KEEHCPLAWG NINLFDYTDT LVSGKMALNL WPVPHGLEDL LNPIGVTGSN PNKETPCLEL EFDWF SSVV KFPDMSVIEE HANWSVSREA GFSYSHAGLS NRLARDNELR ENDKEQLKAI STRDPLSEIT EQEKDFLWSH RHYCVT IPE ILPKLLLSVK WNSRDEVAQM YCLVKDWPPI KPEQAMELLD CNYPDPMVRG FAVRCLEKYL TDDKLSQYLI QLVQVLK YE QYLDNLLVRF LLKKALTNQR IGHFFFWHLK SEMHNKTVSQ RFGLLLESYC RACGMYLKHL NRQVEAMEKL INLTDILK Q EKKDETQKVQ MKFLVEQMRR PDFMDALQGF LSPLNPAHQL GNLRLEECRI MSSAKRPLWL NWENPDIMSE LLFQNNEII FKNGDDLRQD MLTLQIIRIM ENIWQNQGLD LRMLPYGCLS IGDCVGLIEV VRNSHTIMQI QCKGGLKGAL QFNSHTLHQW LKDKNKGEI YDAAIDLFTR SCAGYCVATF ILGIGDRHNS NIMVKDDGQL FHIDFGHFLD HKKKKFGYKR ERVPFVLTQD F LIVISKGA QECTKTREFE RFQEMCYKAY LAIRQHANLF INLFSMMLGS GMPELQSFDD IAYIRKTLAL DKTEQEALEY FM KQMNDAR HGGWTTKMDA AAHTIKQHAL N UniProtKB: Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform |
-分子 #2: Phosphatidylinositol 3-kinase regulatory subunit alpha
| 分子 | 名称: Phosphatidylinositol 3-kinase regulatory subunit alpha タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 33.666961 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MNNNMSLQDA EWYWGDISRE EVNEKLRDTA DGTFLVRDAS TKMHGDYTLT LRKGGNNKLI KIFHRDGKYG FSDPLTFSSV VELINHYRN ESLAQYNPKL DVKLLYPVSK YQQDQVVKED NIEAVGKKLH EYNTQFQEKS REYDRLYEEY TRTSQEIQMK R TAIEAFNE ...文字列: MNNNMSLQDA EWYWGDISRE EVNEKLRDTA DGTFLVRDAS TKMHGDYTLT LRKGGNNKLI KIFHRDGKYG FSDPLTFSSV VELINHYRN ESLAQYNPKL DVKLLYPVSK YQQDQVVKED NIEAVGKKLH EYNTQFQEKS REYDRLYEEY TRTSQEIQMK R TAIEAFNE TIKIFEEQCQ TQERYSKEYI EKFKREGNEK EIQRIMHNYD KLKSRISEII DSRRRLEEDL KKQAAEYREI DK RMNSIKP DLIQLRKTRD QYLMWLTQKG VRQKKLNEWL GN UniProtKB: Phosphatidylinositol 3-kinase regulatory subunit alpha |
-分子 #3: 1-[(1S)-1-(5-fluoranyl-3-methyl-1-benzofuran-2-yl)-2-methyl-propy...
| 分子 | 名称: 1-[(1S)-1-(5-fluoranyl-3-methyl-1-benzofuran-2-yl)-2-methyl-propyl]-3-(1-oxidanylidene-2,3-dihydroisoindol-5-yl)urea タイプ: ligand / ID: 3 / コピー数: 1 / 式: UJ3 |
|---|---|
| 分子量 | 理論値: 395.427 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: DIFFRACTION 回折 / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.0 µm 回折 / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 48.5 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)