+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human OGT-OGA complex | |||||||||
 マップデータ マップデータ | Human OGT-OGA Complex Conformer I | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  O-GlcNAc transferase (O-GlcNAc転移酵素) / O-GlcNAc transferase (O-GlcNAc転移酵素) /  O-GlcNAcase (O-GlcNAcアーゼ) / O-GlcNAcase (O-GlcNAcアーゼ) /  Complex / Mutual inhibition / Complex / Mutual inhibition /  TRANSFERASE (転移酵素) / TRANSFERASE-HYDROLASE complex TRANSFERASE (転移酵素) / TRANSFERASE-HYDROLASE complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glycoprotein metabolic process /  protein N-acetylglucosaminyltransferase complex / hyalurononglucosaminidase activity / protein N-acetylglucosaminyltransferase complex / hyalurononglucosaminidase activity /  O-GlcNAc転移酵素 / N-acetylglucosamine metabolic process / regulation of insulin receptor signaling pathway / protein O-acetylglucosaminyltransferase activity / positive regulation of transcription from RNA polymerase II promoter by glucose / glycoprotein catabolic process / O-GlcNAc転移酵素 / N-acetylglucosamine metabolic process / regulation of insulin receptor signaling pathway / protein O-acetylglucosaminyltransferase activity / positive regulation of transcription from RNA polymerase II promoter by glucose / glycoprotein catabolic process /  O-GlcNAcアーゼ ...glycoprotein metabolic process / O-GlcNAcアーゼ ...glycoprotein metabolic process /  protein N-acetylglucosaminyltransferase complex / hyalurononglucosaminidase activity / protein N-acetylglucosaminyltransferase complex / hyalurononglucosaminidase activity /  O-GlcNAc転移酵素 / N-acetylglucosamine metabolic process / regulation of insulin receptor signaling pathway / protein O-acetylglucosaminyltransferase activity / positive regulation of transcription from RNA polymerase II promoter by glucose / glycoprotein catabolic process / O-GlcNAc転移酵素 / N-acetylglucosamine metabolic process / regulation of insulin receptor signaling pathway / protein O-acetylglucosaminyltransferase activity / positive regulation of transcription from RNA polymerase II promoter by glucose / glycoprotein catabolic process /  O-GlcNAcアーゼ / O-GlcNAcアーゼ /  : / : /  : / [protein]-3-O-(N-acetyl-D-glucosaminyl)-L-serine/L-threonine O-N-acetyl-alpha-D-glucosaminase activity / acetylglucosaminyltransferase activity / regulation of necroptotic process / regulation of Rac protein signal transduction / negative regulation of stem cell population maintenance / protein O-linked glycosylation / protein deglycosylation / NSL complex / : / regulation of neurotransmitter receptor localization to postsynaptic specialization membrane / regulation of glycolytic process / RIPK1-mediated regulated necrosis / : / [protein]-3-O-(N-acetyl-D-glucosaminyl)-L-serine/L-threonine O-N-acetyl-alpha-D-glucosaminase activity / acetylglucosaminyltransferase activity / regulation of necroptotic process / regulation of Rac protein signal transduction / negative regulation of stem cell population maintenance / protein O-linked glycosylation / protein deglycosylation / NSL complex / : / regulation of neurotransmitter receptor localization to postsynaptic specialization membrane / regulation of glycolytic process / RIPK1-mediated regulated necrosis /  regulation of synapse assembly / regulation of synapse assembly /  regulation of gluconeogenesis / positive regulation of stem cell population maintenance / Formation of WDR5-containing histone-modifying complexes / positive regulation of proteolysis / phosphatidylinositol-3,4,5-trisphosphate binding / regulation of gluconeogenesis / positive regulation of stem cell population maintenance / Formation of WDR5-containing histone-modifying complexes / positive regulation of proteolysis / phosphatidylinositol-3,4,5-trisphosphate binding /  マイトファジー / マイトファジー /  造血 / negative regulation of proteasomal ubiquitin-dependent protein catabolic process / 造血 / negative regulation of proteasomal ubiquitin-dependent protein catabolic process /  histone acetyltransferase complex / positive regulation of lipid biosynthetic process / negative regulation of protein ubiquitination / positive regulation of TORC1 signaling / response to nutrient / negative regulation of cell migration / positive regulation of translation / cell projection / histone acetyltransferase complex / positive regulation of lipid biosynthetic process / negative regulation of protein ubiquitination / positive regulation of TORC1 signaling / response to nutrient / negative regulation of cell migration / positive regulation of translation / cell projection /  beta-N-acetylglucosaminidase activity / cellular response to glucose stimulus / beta-N-acetylglucosaminidase activity / cellular response to glucose stimulus /  ミトコンドリア / negative regulation of transforming growth factor beta receptor signaling pathway / circadian regulation of gene expression / response to insulin / Regulation of necroptotic cell death / protein processing / chromatin DNA binding / UCH proteinases / positive regulation of cold-induced thermogenesis / chromatin organization / HATs acetylate histones / glutamatergic synapse / apoptotic process / regulation of transcription by RNA polymerase II / positive regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II / ミトコンドリア / negative regulation of transforming growth factor beta receptor signaling pathway / circadian regulation of gene expression / response to insulin / Regulation of necroptotic cell death / protein processing / chromatin DNA binding / UCH proteinases / positive regulation of cold-induced thermogenesis / chromatin organization / HATs acetylate histones / glutamatergic synapse / apoptotic process / regulation of transcription by RNA polymerase II / positive regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II /  シグナル伝達 / positive regulation of transcription by RNA polymerase II / protein-containing complex / シグナル伝達 / positive regulation of transcription by RNA polymerase II / protein-containing complex /  核質 / 核質 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.92 Å クライオ電子顕微鏡法 / 解像度: 3.92 Å | |||||||||
 データ登録者 データ登録者 | Lu P / Liu Y / Yu H / Gao H | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Cryo-EM structure of human O-GlcNAcylation enzyme pair OGT-OGA complex. 著者: Ping Lu / Yusong Liu / Maozhou He / Ting Cao / Mengquan Yang / Shutao Qi / Hongtao Yu / Haishan Gao /  要旨: O-GlcNAcylation is a conserved post-translational modification that attaches N-acetyl glucosamine (GlcNAc) to myriad cellular proteins. In response to nutritional and hormonal signals, O- ...O-GlcNAcylation is a conserved post-translational modification that attaches N-acetyl glucosamine (GlcNAc) to myriad cellular proteins. In response to nutritional and hormonal signals, O-GlcNAcylation regulates diverse cellular processes by modulating the stability, structure, and function of target proteins. Dysregulation of O-GlcNAcylation has been implicated in the pathogenesis of cancer, diabetes, and neurodegeneration. A single pair of enzymes, the O-GlcNAc transferase (OGT) and O-GlcNAcase (OGA), catalyzes the addition and removal of O-GlcNAc on over 3,000 proteins in the human proteome. However, how OGT selects its native substrates and maintains the homeostatic control of O-GlcNAcylation of so many substrates against OGA is not fully understood. Here, we present the cryo-electron microscopy (cryo-EM) structures of human OGT and the OGT-OGA complex. Our studies reveal that OGT forms a functionally important scissor-shaped dimer. Within the OGT-OGA complex structure, a long flexible OGA segment occupies the extended substrate-binding groove of OGT and positions a serine for O-GlcNAcylation, thus preventing OGT from modifying other substrates. Conversely, OGT disrupts the functional dimerization of OGA and occludes its active site, resulting in the blocking of access by other substrates. This mutual inhibition between OGT and OGA may limit the futile O-GlcNAcylation cycles and help to maintain O-GlcNAc homeostasis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
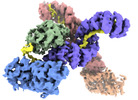
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33773.map.gz emd_33773.map.gz | 118 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33773-v30.xml emd-33773-v30.xml emd-33773.xml emd-33773.xml | 20.8 KB 20.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33773.png emd_33773.png | 123.3 KB | ||
| Filedesc metadata |  emd-33773.cif.gz emd-33773.cif.gz | 7.2 KB | ||
| その他 |  emd_33773_half_map_1.map.gz emd_33773_half_map_1.map.gz emd_33773_half_map_2.map.gz emd_33773_half_map_2.map.gz | 118 MB 115.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33773 http://ftp.pdbj.org/pub/emdb/structures/EMD-33773 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33773 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33773 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33773.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33773.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human OGT-OGA Complex Conformer I | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8389 Å | ||||||||||||||||||||
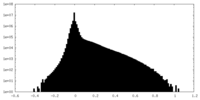
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map
| ファイル | emd_33773_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
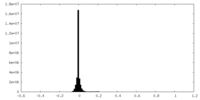
| 密度ヒストグラム |
-ハーフマップ: Half map
| ファイル | emd_33773_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
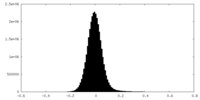
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM structure of human OGT-OGA complex
| 全体 | 名称: Cryo-EM structure of human OGT-OGA complex |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM structure of human OGT-OGA complex
| 超分子 | 名称: Cryo-EM structure of human OGT-OGA complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 400 KDa |
-分子 #1: UDP-N-acetylglucosamine--peptide N-acetylglucosaminyltransferase ...
| 分子 | 名称: UDP-N-acetylglucosamine--peptide N-acetylglucosaminyltransferase 110 kDa subunit タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号:  O-GlcNAc転移酵素 O-GlcNAc転移酵素 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 117.953414 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: MASSVGNVAD STEPTKRMLS FQGLMELAHR EYQAGDFEAA ERHCMQLWRQ EPDNTGVLLL LSSIHFECRR LDRSAHFSTL AIKQNPLLA EAYSNLGNVY KERGQLQEAI EHYRHALRLK PDFIDGYINL AAALVAAGDM EGAVQAYVSA LQYNPDLYCV R SDLGNLLK ...文字列: MASSVGNVAD STEPTKRMLS FQGLMELAHR EYQAGDFEAA ERHCMQLWRQ EPDNTGVLLL LSSIHFECRR LDRSAHFSTL AIKQNPLLA EAYSNLGNVY KERGQLQEAI EHYRHALRLK PDFIDGYINL AAALVAAGDM EGAVQAYVSA LQYNPDLYCV R SDLGNLLK ALGRLEEAKA CYLKAIETQP NFAVAWSNLG CVFNAQGEIW LAIHHFEKAV TLDPNFLDAY INLGNVLKEA RI FDRAVAA YLRALSLSPN HAVVHGNLAC VYYEQGLIDL AIDTYRRAIE LQPHFPDAYC NLANALKEKG SVAEAEDCYN TAL RLCPTH ADSLNNLANI KREQGNIEEA VRLYRKALEV FPEFAAAHSN LASVLQQQGK LQEALMHYKE AIRISPTFAD AYSN MGNTL KEMQDVQGAL QCYTRAIQIN PAFADAHSNL ASIHKDSGNI PEAIASYRTA LKLKPDFPDA YCNLAHCLQI VCDWT DYDE RMKKLVSIVA DQLEKNRLPS VHPHHSMLYP LSHGFRKAIA ERHGNLCLDK INVLHKPPYE HPKDLKLSDG RLRVGY VSS DFGNHPTSHL MQSIPGMHNP DKFEVFCYAL SPDDGTNFRV KVMAEANHFI DLSQIPCNGK AADRIHQDGI HILVNMN GY TKGARNELFA LRPAPIQAMW LGYPGTSGAL FMDYIITDQE TSPAEVAEQY SEKLAYMPHT FFIGDHANMF PHLKKKAV I DFKSNGHIYD NRIVLNGIDL KAFLDSLPDV KIVKMKCPDG GDNADSSNTA LNMPVIPMNT IAEAVIEMIN RGQIQITIN GFSISNGLAT TQINNKAATG EEVPRTIIVT TRSQYGLPED AIVYCNFNQL YKIDPSTLQM WANILKRVPN SVLWLLRFPA VGEPNIQQY AQNMGLPQNR IIFSPVAPKE EHVRRGQLAD VCLDTPLCNG HTTGMDVLWA GTPMVTMPGE TLASRVAASQ L TCLGCLEL IAKNRQEYED IAVKLGTDLE YLKKVRGKVW KQRISSPLFN TKQYTMELER LYLQMWEHYA AGNKPDHMIK PV EVTESAH HHHHH UniProtKB: UDP-N-acetylglucosamine--peptide N-acetylglucosaminyltransferase 110 kDa subunit |
-分子 #2: Protein O-GlcNAcase
| 分子 | 名称: Protein O-GlcNAcase / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO / EC番号:  O-GlcNAcアーゼ O-GlcNAcアーゼ |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 103.020906 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: MVQKESQATL EERESELSSN PAASAGASLE PPAAPAPGED NPAGAGGAAV AGAAGGARRF LCGVVEGFYG RPWVMEQRKE LFRRLQKWE LNTYLYAPKD DYKHRMFWRE MYSVEEAEQL MTLISAAREY EIEFIYAISP GLDITFSNPK EVSTLKRKLD Q VSQFGCRS ...文字列: MVQKESQATL EERESELSSN PAASAGASLE PPAAPAPGED NPAGAGGAAV AGAAGGARRF LCGVVEGFYG RPWVMEQRKE LFRRLQKWE LNTYLYAPKD DYKHRMFWRE MYSVEEAEQL MTLISAAREY EIEFIYAISP GLDITFSNPK EVSTLKRKLD Q VSQFGCRS FALLFDDIDH NMCAADKEVF SSFAHAQVSI TNEIYQYLGE PETFLFCPTE YCGTFCYPNV SQSPYLRTVG EK LLPGIEV LWTGPKVVSK EIPVESIEEV SKIIKRAPVI WDNIHANDYD QKRLFLGPYK GRSTELIPRL KGVLTNPNCE FEA NYVAIH TLATWYKSNM NGVRKDVVMT DSEDSTVSIQ IKLENEGSDE DIETDVLYSP QMALKLALTE WLQEFGVPHQ YSSR QVAHS GAKASVVDGT PLVAAPSLNA TTVVTTVYQE PIMSQGAALS GEPTTLTKEE EKKQPDEEPM DMVVEKQEET DHKND NQIL SEIVEAKMAE ELKPMDTDKE SIAESKSPEM SMQEDCISDI APMQTDEQTN KEQFVPGPNE KPLYTAEPVT LEDLQL LAD LFYLPYEHGP KGAQMLREFQ WLRANSSVVS VNCKGKDSEK IEEWRSRAAK FEEMCGLVMG MFTRLSNCAN RTILYDM YS YVWDIKSIMS MVKSFVQWLG CRSHSSAQFL IGDQEPWAFR GGLAGEFQRL LPIDGANDLF FQPPPLTPTS KVYTIRPY F PKDEASVYKI CREMYDDGVG LPFQSQPDLI GDKLVGGLLS LSLDYCFVLE DEDGICGYAL GTVDVTPFIK KCKISWIPF MQEKYTKPNG DKELSEAEKI MLSFHEEQEV LPETFLANFP SLIKMDIHKK VTDPSVAKSM MACLLSSLKA NGSRGAFCEV RPDDKRILE FYSKLGCFEI AKMEGFPKDV VILGRSL UniProtKB:  O-GlcNAcアーゼ O-GlcNAcアーゼ |
-分子 #3: URIDINE-5'-DIPHOSPHATE
| 分子 | 名称: URIDINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: UDP |
|---|---|
| 分子量 | 理論値: 404.161 Da |
| Chemical component information |  ChemComp-UDP: |
-分子 #4: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 4 / コピー数: 1 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 1.3 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 114543 |
|---|---|
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: 詳細: 1W3B, 3PE3, 5UN9 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: cryoSPARC |
| 最終 3次元分類 | クラス数: 3 / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: cryoSPARC |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.92 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 使用した粒子像数: 114543 |
-原子モデル構築 1
| 初期モデル |
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 温度因子: 146 | ||||||||
| 得られたモデル |  PDB-7yeh: |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X