機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /  データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 キーワード
キーワード TRANSCRIPTION (転写 (生物学))
TRANSCRIPTION (転写 (生物学)) 機能・相同性情報
機能・相同性情報 RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility ...bacterial-type RNA polymerase core enzyme binding / ATP-dependent activity, acting on RNA / transcription elongation-coupled chromatin remodeling /
RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility ...bacterial-type RNA polymerase core enzyme binding / ATP-dependent activity, acting on RNA / transcription elongation-coupled chromatin remodeling /  RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation / transcription antitermination /
RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation / transcription elongation factor complex / regulation of DNA-templated transcription elongation / transcription antitermination /  運動性 /
運動性 /  helicase activity / DNA-templated transcription initiation / DNA-templated transcription termination /
helicase activity / DNA-templated transcription initiation / DNA-templated transcription termination /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /
加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /  ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity /
ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity /  ポリメラーゼ /
ポリメラーゼ /  リボソーム生合成 / protein complex oligomerization / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis /
リボソーム生合成 / protein complex oligomerization / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis /  protein dimerization activity / DNA-binding transcription factor activity / protein domain specific binding / response to antibiotic /
protein dimerization activity / DNA-binding transcription factor activity / protein domain specific binding / response to antibiotic /  nucleotide binding / magnesium ion binding /
nucleotide binding / magnesium ion binding /  ATP hydrolysis activity /
ATP hydrolysis activity /  DNA binding /
DNA binding /  RNA binding / zinc ion binding /
RNA binding / zinc ion binding /  ATP binding /
ATP binding /  生体膜 / identical protein binding /
生体膜 / identical protein binding /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Escherichia coli (strain K12) (大腸菌) /
Escherichia coli (strain K12) (大腸菌) / 
 Escherichia coli K-12 (大腸菌)
Escherichia coli K-12 (大腸菌) 単粒子再構成法 /
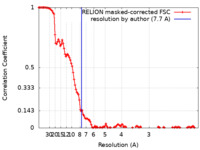
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 7.7 Å
クライオ電子顕微鏡法 / 解像度: 7.7 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Mol Cell / 年: 2021
ジャーナル: Mol Cell / 年: 2021

 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_22115.map.gz
emd_22115.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-22115-v30.xml
emd-22115-v30.xml emd-22115.xml
emd-22115.xml EMDBヘッダ
EMDBヘッダ emd_22115_fsc.xml
emd_22115_fsc.xml FSCデータファイル
FSCデータファイル emd_22115.png
emd_22115.png emd-22115.cif.gz
emd-22115.cif.gz emd_22115_additional_1.map.gz
emd_22115_additional_1.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-22115
http://ftp.pdbj.org/pub/emdb/structures/EMD-22115 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22115
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22115 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_22115.map.gz / 形式: CCP4 / 大きさ: 163.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_22115.map.gz / 形式: CCP4 / 大きさ: 163.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 クライオ電子顕微鏡法
クライオ電子顕微鏡法 解析
解析 単粒子再構成法
単粒子再構成法 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN Bright-field microscopy
Bright-field microscopy
 画像解析
画像解析
 ムービー
ムービー コントローラー
コントローラー


























 Z
Z Y
Y X
X