機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /  データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility ...bacterial-type RNA polymerase core enzyme binding / ATP-dependent activity, acting on RNA / transcription elongation-coupled chromatin remodeling /
RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility ...bacterial-type RNA polymerase core enzyme binding / ATP-dependent activity, acting on RNA / transcription elongation-coupled chromatin remodeling /  RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation /
RNA polymerase complex / submerged biofilm formation / cellular response to cell envelope stress / cytosolic DNA-directed RNA polymerase complex / regulation of DNA-templated transcription initiation / bacterial-type flagellum assembly / bacterial-type flagellum-dependent cell motility / nitrate assimilation /  translation elongation factor activity / transcription elongation factor complex /
translation elongation factor activity / transcription elongation factor complex /  DNA-directed RNA polymerase complex / regulation of DNA-templated transcription elongation / transcription antitermination /
DNA-directed RNA polymerase complex / regulation of DNA-templated transcription elongation / transcription antitermination /  helicase activity /
helicase activity /  運動性 / DNA-templated transcription termination / DNA-templated transcription initiation /
運動性 / DNA-templated transcription termination / DNA-templated transcription initiation /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /
加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 /  ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity /
ribonucleoside binding / DNA-directed 5'-3' RNA polymerase activity /  ポリメラーゼ /
ポリメラーゼ /  リボソーム生合成 / protein complex oligomerization / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis /
リボソーム生合成 / protein complex oligomerization / response to heat / protein-containing complex assembly / intracellular iron ion homeostasis /  protein dimerization activity / DNA-binding transcription factor activity / protein domain specific binding /
protein dimerization activity / DNA-binding transcription factor activity / protein domain specific binding /  nucleotide binding / response to antibiotic / DNA-templated transcription / magnesium ion binding /
nucleotide binding / response to antibiotic / DNA-templated transcription / magnesium ion binding /  ATP hydrolysis activity /
ATP hydrolysis activity /  DNA binding /
DNA binding /  RNA binding / zinc ion binding /
RNA binding / zinc ion binding /  ATP binding /
ATP binding /  生体膜 / identical protein binding /
生体膜 / identical protein binding /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) 単粒子再構成法 /
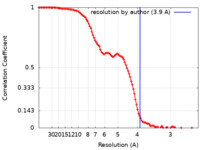
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.9 Å
クライオ電子顕微鏡法 / 解像度: 3.9 Å  データ登録者
データ登録者 ドイツ,
ドイツ,  米国, 4件
米国, 4件  引用
引用 ジャーナル: Science / 年: 2021
ジャーナル: Science / 年: 2021



 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_11087.map.gz
emd_11087.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-11087-v30.xml
emd-11087-v30.xml emd-11087.xml
emd-11087.xml EMDBヘッダ
EMDBヘッダ emd_11087_fsc.xml
emd_11087_fsc.xml FSCデータファイル
FSCデータファイル emd_11087.png
emd_11087.png http://ftp.pdbj.org/pub/emdb/structures/EMD-11087
http://ftp.pdbj.org/pub/emdb/structures/EMD-11087 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11087
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11087 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_11087.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_11087.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌)
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) クライオ電子顕微鏡法
クライオ電子顕微鏡法 解析
解析 単粒子再構成法
単粒子再構成法 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN Bright-field microscopy / Cs: 2.0 mm / 最大 デフォーカス(公称値): 25.0 µm / 最小 デフォーカス(公称値): 8.0 µm / 倍率(公称値): 31000
Bright-field microscopy / Cs: 2.0 mm / 最大 デフォーカス(公称値): 25.0 µm / 最小 デフォーカス(公称値): 8.0 µm / 倍率(公称値): 31000 
 ムービー
ムービー コントローラー
コントローラー