+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3698 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | motor domain of complete human dynein-1 in the state of phi-particle | |||||||||
 マップデータ マップデータ | locally masked region of motor domain from complete human dynein-1 phi-particle | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  motor protein (モータータンパク質) / motor protein (モータータンパク質) /  dynein (ダイニン) / dynein (ダイニン) /  motor domain (機関 (機械)) / motor domain (機関 (機械)) /  AAA+ AAA+ | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of intracellular transport / regulation of metaphase plate congression / establishment of spindle localization / positive regulation of spindle assembly /  P-body assembly / P-body assembly /  dynein complex / COPI-independent Golgi-to-ER retrograde traffic / minus-end-directed microtubule motor activity / dynein complex / COPI-independent Golgi-to-ER retrograde traffic / minus-end-directed microtubule motor activity /  cytoplasmic dynein complex / retrograde axonal transport ...positive regulation of intracellular transport / regulation of metaphase plate congression / establishment of spindle localization / positive regulation of spindle assembly / cytoplasmic dynein complex / retrograde axonal transport ...positive regulation of intracellular transport / regulation of metaphase plate congression / establishment of spindle localization / positive regulation of spindle assembly /  P-body assembly / P-body assembly /  dynein complex / COPI-independent Golgi-to-ER retrograde traffic / minus-end-directed microtubule motor activity / dynein complex / COPI-independent Golgi-to-ER retrograde traffic / minus-end-directed microtubule motor activity /  cytoplasmic dynein complex / retrograde axonal transport / dynein light intermediate chain binding / nuclear migration / dynein intermediate chain binding / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / COPI-mediated anterograde transport / cytoplasmic microtubule organization / cytoplasmic dynein complex / retrograde axonal transport / dynein light intermediate chain binding / nuclear migration / dynein intermediate chain binding / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule / COPI-mediated anterograde transport / cytoplasmic microtubule organization /  stress granule assembly / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / regulation of mitotic spindle organization / axon cytoplasm / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / AURKA Activation by TPX2 / mitotic spindle organization / stress granule assembly / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / regulation of mitotic spindle organization / axon cytoplasm / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / AURKA Activation by TPX2 / mitotic spindle organization /  filopodium / RHO GTPases Activate Formins / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / azurophil granule lumen / filopodium / RHO GTPases Activate Formins / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / azurophil granule lumen /  Regulation of PLK1 Activity at G2/M Transition / positive regulation of cold-induced thermogenesis / Regulation of PLK1 Activity at G2/M Transition / positive regulation of cold-induced thermogenesis /  細胞皮質 / 細胞皮質 /  微小管 / 微小管 /  細胞分裂 / 細胞分裂 /  中心体 / Neutrophil degranulation / 中心体 / Neutrophil degranulation /  ATP hydrolysis activity / ATP hydrolysis activity /  RNA binding / extracellular exosome / extracellular region / RNA binding / extracellular exosome / extracellular region /  ATP binding / ATP binding /  生体膜 / 生体膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
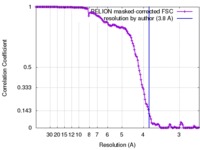
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.8 Å クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | Zhang K / Foster H | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2017 ジャーナル: Cell / 年: 2017タイトル: Cryo-EM Reveals How Human Cytoplasmic Dynein Is Auto-inhibited and Activated. 著者: Kai Zhang / Helen E Foster / Arnaud Rondelet / Samuel E Lacey / Nadia Bahi-Buisson / Alexander W Bird / Andrew P Carter /    要旨: Cytoplasmic dynein-1 binds dynactin and cargo adaptor proteins to form a transport machine capable of long-distance processive movement along microtubules. However, it is unclear why dynein-1 moves ...Cytoplasmic dynein-1 binds dynactin and cargo adaptor proteins to form a transport machine capable of long-distance processive movement along microtubules. However, it is unclear why dynein-1 moves poorly on its own or how it is activated by dynactin. Here, we present a cryoelectron microscopy structure of the complete 1.4-megadalton human dynein-1 complex in an inhibited state known as the phi-particle. We reveal the 3D structure of the cargo binding dynein tail and show how self-dimerization of the motor domains locks them in a conformation with low microtubule affinity. Disrupting motor dimerization with structure-based mutagenesis drives dynein-1 into an open form with higher affinity for both microtubules and dynactin. We find the open form is also inhibited for movement and that dynactin relieves this by reorienting the motor domains to interact correctly with microtubules. Our model explains how dynactin binding to the dynein-1 tail directly stimulates its motor activity. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3698.map.gz emd_3698.map.gz | 15.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3698-v30.xml emd-3698-v30.xml emd-3698.xml emd-3698.xml | 20.1 KB 20.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_3698_fsc.xml emd_3698_fsc.xml | 13.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_3698.png emd_3698.png | 125.4 KB | ||
| Filedesc metadata |  emd-3698.cif.gz emd-3698.cif.gz | 9.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3698 http://ftp.pdbj.org/pub/emdb/structures/EMD-3698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3698 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3698.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3698.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | locally masked region of motor domain from complete human dynein-1 phi-particle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.32 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Motor domains from human cytoplasmic dynein-1 in the phi-particle...
| 全体 | 名称: Motor domains from human cytoplasmic dynein-1 in the phi-particle conformation |
|---|---|
| 要素 |
|
-超分子 #1: Motor domains from human cytoplasmic dynein-1 in the phi-particle...
| 超分子 | 名称: Motor domains from human cytoplasmic dynein-1 in the phi-particle conformation タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Cytoplasmic dynein 1 heavy chain 1
| 分子 | 名称: Cytoplasmic dynein 1 heavy chain 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 533.08325 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MSEPGGGGGE DGSAGLEVSA VQNVADVSVL QKHLRKLVPL LLEDGGEAPA ALEAALEEKS ALEQMRKFLS DPQVHTVLVE RSTLKEDVG DEGEEEKEFI SYNINIDIHY GVKSNSLAFI KRTPVIDADK PVSSQLRVLT LSEDSPYETL HSFISNAVAP F FKSYIRES ...文字列: MSEPGGGGGE DGSAGLEVSA VQNVADVSVL QKHLRKLVPL LLEDGGEAPA ALEAALEEKS ALEQMRKFLS DPQVHTVLVE RSTLKEDVG DEGEEEKEFI SYNINIDIHY GVKSNSLAFI KRTPVIDADK PVSSQLRVLT LSEDSPYETL HSFISNAVAP F FKSYIRES GKADRDGDKM APSVEKKIAE LEMGLLHLQQ NIEIPEISLP IHPMITNVAK QCYERGEKPK VTDFGDKVED PT FLNQLQS GVNRWIREIQ KVTKLDRDPA SGTALQEISF WLNLERALYR IQEKRESPEV LLTLDILKHG KRFHATVSFD TDT GLKQAL ETVNDYNPLM KDFPLNDLLS ATELDKIRQA LVAIFTHLRK IRNTKYPIQR ALRLVEAISR DLSSQLLKVL GTRK LMHVA YEEFEKVMVA CFEVFQTWDD EYEKLQVLLR DIVKRKREEN LKMVWRINPA HRKLQARLDQ MRKFRRQHEQ LRAVI VRVL RPQVTAVAQQ NQGEVPEPQD MKVAEVLFDA ADANAIEEVN LAYENVKEVD GLDVSKEGTE AWEAAMKRYD ERIDRV ETR ITARLRDQLG TAKNANEMFR IFSRFNALFV RPHIRGAIRE YQTQLIQRVK DDIESLHDKF KVQYPQSQAC KMSHVRD LP PVSGSIIWAK QIDRQLTAYM KRVEDVLGKG WENHVEGQKL KQDGDSFRMK LNTQEIFDDW ARKVQQRNLG VSGRIFTI E STRVRGRTGN VLKLKVNFLP EIITLSKEVR NLKWLGFRVP LAIVNKAHQA NQLYPFAISL IESVRTYERT CEKVEERNT ISLLVAGLKK EVQALIAEGI ALVWESYKLD PYVQRLAETV FNFQEKVDDL LIIEEKIDLE VRSLETCMYD HKTFSEILNR VQKAVDDLN LHSYSNLPIW VNKLDMEIER ILGVRLQAGL RAWTQVLLGQ AEDKAEVDMD TDAPQVSHKP GGEPKIKNVV H ELRITNQV IYLNPPIEEC RYKLYQEMFA WKMVVLSLPR IQSQRYQVGV HYELTEEEKF YRNALTRMPD GPVALEESYS AV MGIVSEV EQYVKVWLQY QCLWDMQAEN IYNRLGEDLN KWQALLVQIR KARGTFDNAE TKKEFGPVVI DYGKVQSKVN LKY DSWHKE VLSKFGQMLG SNMTEFHSQI SKSRQELEQH SVDTASTSDA VTFITYVQSL KRKIKQFEKQ VELYRNGQRL LEKQ RFQFP PSWLYIDNIE GEWGAFNDIM RRKDSAIQQQ VANLQMKIVQ EDRAVESRTT DLLTDWEKTK PVTGNLRPEE ALQAL TIYE GKFGRLKDDR EKCAKAKEAL ELTDTGLLSG SEERVQVALE ELQDLKGVWS ELSKVWEQID QMKEQPWVSV QPRKLR QNL DALLNQLKSF PARLRQYASY EFVQRLLKGY MKINMLVIEL KSEALKDRHW KQLMKRLHVN WVVSELTLGQ IWDVDLQ KN EAIVKDVLLV AQGEMALEEF LKQIREVWNT YELDLVNYQN KCRLIRGWDD LFNKVKEHIN SVSAMKLSPY YKVFEEDA L SWEDKLNRIM ALFDVWIDVQ RRWVYLEGIF TGSADIKHLL PVETQRFQSI STEFLALMKK VSKSPLVMDV LNIQGVQRS LERLADLLGK IQKALGEYLE RERSSFPRFY FVGDEDLLEI IGNSKNVAKL QKHFKKMFAG VSSIILNEDN SVVLGISSRE GEEVMFKTP VSITEHPKIN EWLTLVEKEM RVTLAKLLAE SVTEVEIFGK ATSIDPNTYI TWIDKYQAQL VVLSAQIAWS E NVETALSS MGGGGDAAPL HSVLSNVEVT LNVLADSVLM EQPPLRRRKL EHLITELVHQ RDVTRSLIKS KIDNAKSFEW LS QMRFYFD PKQTDVLQQL SIQMANAKFN YGFEYLGVQD KLVQTPLTDR CYLTMTQALE ARLGGSPFGP AGTGKTESVK ALG HQLGRF VLVFNCDETF DFQAMGRIFV GLCQVGAWGC FDEFNRLEER MLSAVSQQVQ CIQEALREHS NPNYDKTSAP ITCE LLNKQ VKVSPDMAIF ITMNPGYAGR SNLPDNLKKL FRSLAMTKPD RQLIAQVMLY SQGFRTAEVL ANKIVPFFKL CDEQL SSQS HYDFGLRALK SVLVSAGNVK RERIQKIKRE KEERGEAVDE GEIAENLPEQ EILIQSVCET MVPKLVAEDI PLLFSL LSD VFPGVQYHRG EMTALREELK KVCQEMYLTY GDGEEVGGMW VEKVLQLYQI TQINHGLMMV GPSGSGKSMA WRVLLKA LE RLEGVEGVAH IIDPKAISKD HLYGTLDPNT REWTDGLFTH VLRKIIDSVR GELQKRQWIV FDGDVDPEWV ENLNSVLD D NKLLTLPNGE RLSLPPNVRI MFEVQDLKYA TLATVSRCGM VWFSEDVLST DMIFNNFLAR LRSIPLDEGE DEAQRRRKG KEDEGEEAAS PMLQIQRDAA TIMQPYFTSN GLVTKALEHA FQLEHIMDLT RLRCLGSLFS MLHQACRNVA QYNANHPDFP MQIEQLERY IQRYLVYAIL WSLSGDSRLK MRAELGEYIR RITTVPLPTA PNIPIIDYEV SISGEWSPWQ AKVPQIEVET H KVAAPDVV VPTLDTVRHE ALLYTWLAEH KPLVLCGPPG SGKTMTLFSA LRALPDMEVV GLNFSSATTP ELLLKTFDHY CE YRRTPNG VVLAPVQLGK WLVLFCDEIN LPDMDKYGTQ RVISFIRQMV EHGGFYRTSD QTWVKLERIQ FVGACNPPTD PGR KPLSHR FLRHVPVVYV DYPGPASLTQ IYGTFNRAML RLIPSLRTYA EPLTAAMVEF YTMSQERFTQ DTQPHYIYSP REMT RWVRG IFEALRPLET LPVEGLIRIW AHEALRLFQD RLVEDEERRW TDENIDTVAL KHFPNIDREK AMSRPILYSN WLSKD YIPV DQEELRDYVK ARLKVFYEEE LDVPLVLFNE VLDHVLRIDR IFRQPQGHLL LIGVSGAGKT TLSRFVAWMN GLSVYQ IKV HRKYTGEDFD EDLRTVLRRS GCKNEKIAFI MDESNVLDSG FLERMNTLLA NGEVPGLFEG DEYATLMTQC KEGAQKE GL MLDSHEELYK WFTSQVIRNL HVVFTMNPSS EGLKDRAATS PALFNRCVLN WFGDWSTEAL YQVGKEFTSK MDLEKPNY I VPDYMPVVYD KLPQPPSHRE AIVNSCVFVH QTLHQANARL AKRGGRTMAI TPRHYLDFIN HYANLFHEKR SELEEQQMH LNVGLRKIKE TVDQVEELRR DLRIKSQELE VKNAAANDKL KKMVKDQQEA EKKKVMSQEI QEQLHKQQEV IADKQMSVKE DLDKVEPAV IEAQNAVKSI KKQHLVEVRS MANPPAAVKL ALESICLLLG ESTTDWKQIR SIIMRENFIP TIVNFSAEEI S DAIREKMK KNYMSNPSYN YEIVNRASLA CGPMVKWAIA QLNYADMLKR VEPLRNELQK LEDDAKDNQQ KANEVEQMIR DL EASIARY KEEYAVLISE AQAIKADLAA VEAKVNRSTA LLKSLSAERE RWEKTSETFK NQMSTIAGDC LLSAAFIAYA GYF DQQMRQ NLFTTWSHHL QQANIQFRTD IARTEYLSNA DERLRWQASS LPADDLCTEN AIMLKRFNRY PLIIDPSGQA TEFI MNEYK DRKITRTSFL DDAFRKNLES ALRFGNPLLV QDVESYDPVL NPVLNREVRR TGGRVLITLG DQDIDLSPSF VIFLS TRDP TVEFPPDLCS RVTFVNFTVT RSSLQSQCLN EVLKAERPDV DEKRSDLLKL QGEFQLRLRQ LEKSLLQALN EVKGRI LDD DTIITTLENL KREAAEVTRK VEETDIVMQE VETVSQQYLP LSTACSSIYF TMESLKQIHF LYQYSLQFFL DIYHNVL YE NPNLKGVTDH TQRLSIITKD LFQVAFNRVA RGMLHQDHIT FAMLLARIKL KGTVGEPTYD AEFQHFLRGN EIVLSAGS T PRIQGLTVEQ AEAVVRLSCL PAFKDLIAKV QADEQFGIWL DSSSPEQTVP YLWSEETPAT PIGQAIHRLL LIQAFRPDR LLAMAHMFVS TNLGESFMSI MEQPLDLTHI VGTEVKPNTP VLMCSVPGYD ASGHVEDLAA EQNTQITSIA IGSAEGFNQA DKAINTAVK SGRWVMLKNV HLAPGWLMQL EKKLHSLQPH ACFRLFLTME INPKVPVNLL RAGRIFVFEP PPGVKANMLR T FSSIPVSR ICKSPNERAR LYFLLAWFHA IIQERLRYAP LGWSKKYEFG ESDLRSACDT VDTWLDDTAK GRQNISPDKI PW SALKTLM AQSIYGGRVD NEFDQRLLNT FLERLFTTRS FDSEFKLACK VDGHKDIQMP DGIRREEFVQ WVELLPDTQT PSW LGLPNN AERVLLTTQG VDMISKMLKM QMLEDEDDLA YAETEKKTRT DSTSDGRPAW MRTLHTTASN WLHLIPQTLS HLKR TVENI KDPLFRFFER EVKMGAKLLQ DVRQDLADVV QVCEGKKKQT NYLRTLINEL VKGILPRSWS HYTVPAGMTV IQWVS DFSE RIKQLQNISL AAASGGAKEL KNIHVCLGGL FVPEAYITAT RQYVAQANSW SLEELCLEVN VTTSQGATLD ACSFGV TGL KLQGATCNNN KLSLSNAIST ALPLTQLRWV KQTNTEKKAS VVTLPVYLNF TRADLIFTVD FEIATKEDPR SFYERGV AV LCTE UniProtKB: Cytoplasmic dynein 1 heavy chain 1 |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.15 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 20mM HEPES pH7.4, 150 mM KCl, 1mM MgCl2, 5 mM DTT, 0.1 mM ATP |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 50 / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 25 sec. / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | vitrification was performed immediately after gel filtration. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 最大 デフォーカス(補正後): 5.0 µm / 最小 デフォーカス(補正後): 1.5 µm / 倍率(補正後): 106061 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 59000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 59000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 温度 | 最低: 90.0 K / 最高: 100.0 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / デジタル化 - 画像ごとのフレーム数: 3-34 / 撮影したグリッド数: 6746 / 実像数: 312198 / 平均露光時間: 2.0 sec. / 平均電子線量: 1.6 e/Å2 詳細: Images were also collected using K2 summit detetor in counting mode |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: AB INITIO MODEL / 温度因子: 145 |
|---|---|
| 得られたモデル |  PDB-5nug: |
 ムービー
ムービー コントローラー
コントローラー