+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9g0b | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Rhinovirus A2 uncoating intermediate revealing the natural pocket factor (pH 5.8 and 4 degrees Celsius) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | VIRUS / Uncoating Intermediate / Pocket Factor / Lauric Acid | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / ribonucleoside triphosphate phosphatase activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity ...symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / ribonucleoside triphosphate phosphatase activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport / DNA replication / RNA helicase activity / endocytosis involved in viral entry into host cell / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / host cell nucleus / structural molecule activity / proteolysis / RNA binding / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  rhinovirus A2 (ライノウイルス) rhinovirus A2 (ライノウイルス) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||
 データ登録者 データ登録者 | Real-Hohn, A. / Blaas, D. | ||||||
| 資金援助 |  オーストリア, 1件 オーストリア, 1件
| ||||||
 引用 引用 |  ジャーナル: Sci Rep / 年: 2025 ジャーナル: Sci Rep / 年: 2025タイトル: New rhinovirus uncoating intermediate reveals how sodium versus potassium ions influence RNA release. 著者: Antonio Real-Hohn / Dieter Blaas /  要旨: Electron microscopy (EM) of rhinovirus A2 (RV-A2) incubated in Na phosphate buffer (pH 7.6) for 12 h at 25 °C revealed partial fragmentation, whereas upon incubation in K phosphate buffer, RV-A2 ...Electron microscopy (EM) of rhinovirus A2 (RV-A2) incubated in Na phosphate buffer (pH 7.6) for 12 h at 25 °C revealed partial fragmentation, whereas upon incubation in K phosphate buffer, RV-A2 appeared intact. In buffers adjusted to pH 5.8, these differences became more pronounced; acidic Na phosphate buffer promoted disintegration of the particles, whereas in acidic K phosphate buffer, the virus appeared like native. Incubation in the acidic buffers for one hour at 4 °C followed by neutralisation resulted in the respective formation of non-infectious A particles (in Na) and a non-infectious novel uncoating intermediate (in K), which we termed 'E0 particle'. Negative staining EM revealed phosphotungstate penetration into A particles, but not into E0 particles. Cryo-EM image reconstruction of the E0 particle showed clear differences between A and E0 particles; like native virus, E0 contained VP4 and a pocket factor. Native RV-A2 RNA cores, obtained by gentle proteinase-K digestion in K and Na phosphate buffer, respectively, differed in accessibility of dsRNA regions, detected by PaSTRy. Variance in RNA compactness observed in K versus Na phosphate buffer was confirmed by rotary shadowing EM; in K phosphate buffer, the RNA remained condensed while, in Na phosphate buffer, distinct unfolding stages were apparent. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9g0b.cif.gz 9g0b.cif.gz | 173.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9g0b.ent.gz pdb9g0b.ent.gz | 134.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9g0b.json.gz 9g0b.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9g0b_validation.pdf.gz 9g0b_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9g0b_full_validation.pdf.gz 9g0b_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  9g0b_validation.xml.gz 9g0b_validation.xml.gz | 43.6 KB | 表示 | |
| CIF形式データ |  9g0b_validation.cif.gz 9g0b_validation.cif.gz | 64.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/g0/9g0b https://data.pdbj.org/pub/pdb/validation_reports/g0/9g0b ftp://data.pdbj.org/pub/pdb/validation_reports/g0/9g0b ftp://data.pdbj.org/pub/pdb/validation_reports/g0/9g0b | HTTPS FTP |
-関連構造データ
| 関連構造データ |  50930MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 60
|
- 要素
要素
| #1: タンパク質 | 分子量: 32274.100 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 |
|---|---|
| #2: タンパク質 | 分子量: 29009.588 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 |
| #3: タンパク質 | 分子量: 26107.793 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 |
| #4: タンパク質 | 分子量: 7356.971 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 rhinovirus A2 (ライノウイルス) / 参照: UniProt: P04936 |
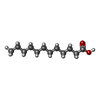
| #5: 化合物 | ChemComp-DAO / |
| 研究の焦点であるリガンドがあるか | Y |
| Has protein modification | N |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: rhinovirus A2 / タイプ: VIRUS / Entity ID: #1-#4 / 由来: NATURAL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | |||||||||||||||
| 由来(天然) | 生物種:  rhinovirus A2 (ライノウイルス) rhinovirus A2 (ライノウイルス) | |||||||||||||||
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: SEROTYPE / タイプ: VIRION | |||||||||||||||
| 天然宿主 | 生物種: Homo sapiens | |||||||||||||||
| ウイルス殻 | 直径: 310 nm / 三角数 (T数): 3 | |||||||||||||||
| 緩衝液 | pH: 5.8 / 詳細: 0.1 M phosphate buffer, pH 5.8 | |||||||||||||||
| 緩衝液成分 |
| |||||||||||||||
| 試料 | 濃度: 10 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES 詳細: The virus sample was purified from HeLa cells, diluted to a final concentration of 1 mg/mL in 100 mM potassium phosphate buffer, pH 5.8, and incubated at four degrees for one hour before the vitrification. | |||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R2/2 | |||||||||||||||
| 急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 80 % / 凍結前の試料温度: 293 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS GLACIOS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 100000 X / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 500 nm / Cs: 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 電子線照射量: 60 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 撮影したグリッド数: 2 / 実像数: 246 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 16372 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 9825 / アルゴリズム: FOURIER SPACE / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 3VDD Accession code: 3VDD / Source name: PDB / タイプ: experimental model |
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj