[English] 日本語
 Yorodumi
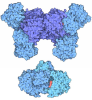
Yorodumi- PDB-8gpb: STRUCTURAL MECHANISM FOR GLYCOGEN PHOSPHORYLASE CONTROL BY PHOSPH... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 8gpb | ||||||
|---|---|---|---|---|---|---|---|
| Title | STRUCTURAL MECHANISM FOR GLYCOGEN PHOSPHORYLASE CONTROL BY PHOSPHORYLATION AND AMP | ||||||
 Components Components | GLYCOGEN PHOSPHORYLASE B | ||||||
 Keywords Keywords | GLYCOGEN PHOSPHORYLASE | ||||||
| Function / homology |  Function and homology information Function and homology informationglycogen phosphorylase / glycogen phosphorylase activity / glycogen catabolic process / skeletal muscle myofibril / pyridoxal phosphate binding / nucleotide binding Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / Resolution: 2.2 Å X-RAY DIFFRACTION / Resolution: 2.2 Å | ||||||
 Authors Authors | Barford, D. / Hu, S.-H. / Johnson, L.N. | ||||||
 Citation Citation |  Journal: J.Mol.Biol. / Year: 1991 Journal: J.Mol.Biol. / Year: 1991Title: Structural mechanism for glycogen phosphorylase control by phosphorylation and AMP. Authors: Barford, D. / Hu, S.H. / Johnson, L.N. #1:  Journal: Glycogen Phosphorylase B: Description of the Protein Structure Journal: Glycogen Phosphorylase B: Description of the Protein StructureTitle: Glycogen Phosphorylase B: Description of the Protein Structure 1 1991 Authors: Acharya, K.R. / Stuart, D.I. / Varvill, K.M. / Johnson, L.N. #2:  Journal: J.Mol.Biol. / Year: 1990 Journal: J.Mol.Biol. / Year: 1990Title: Refined Crystal Structure of the Phosphorylase-Heptulose 2-Phosphate-Oligosaccharide-AMP Complex Authors: Johnson, L.N. / Acharya, K.R. / Jordan, M.D. / Mclaughlin, P.J. #3:  Journal: Biochemistry / Year: 1990 Journal: Biochemistry / Year: 1990Title: Comparison of the Binding of Glucose and Glucose-1-Phosphate Derivatives to T-State Glycogen Phosphorylase B Authors: Martin, J.L. / Johnson, L.N. / Withers, S.G. #4:  Journal: Nature / Year: 1989 Journal: Nature / Year: 1989Title: The Allosteric Transition of Glycogen Phosphorylase Authors: Barford, D. / Johnson, L.N. #5:  Journal: Nature / Year: 1988 Journal: Nature / Year: 1988Title: Structural Changes in Glycogen Phosphorylase Induced by Phosphorylation Authors: Sprang, S.R. / Acharya, K.R. / Goldsmith, E.J. / Stuart, D.I. / Varvill, K. / Fletterick, R.J. / Madsen, N.B. / Johnson, L.N. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  8gpb.cif.gz 8gpb.cif.gz | 199.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb8gpb.ent.gz pdb8gpb.ent.gz | 154.9 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  8gpb.json.gz 8gpb.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/gp/8gpb https://data.pdbj.org/pub/pdb/validation_reports/gp/8gpb ftp://data.pdbj.org/pub/pdb/validation_reports/gp/8gpb ftp://data.pdbj.org/pub/pdb/validation_reports/gp/8gpb | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
| ||||||||
| Atom site foot note | 1: RESIDUE 380 IS LEU IN THE SEQUENCE (K.NAKANO,P.K.HWANG, R.J.FLETTERICK, FEBS LETT., V. 204, P. 283, 1986) BUT IT HAS BEEN PRESENTED AS ILE IN THIS ENTRY. THIS ASSIGNMENT WAS MADE IN THE ORIGINAL ...1: RESIDUE 380 IS LEU IN THE SEQUENCE (K.NAKANO,P.K.HWANG, R.J.FLETTERICK, FEBS LETT., V. 204, P. 283, 1986) BUT IT HAS BEEN PRESENTED AS ILE IN THIS ENTRY. THIS ASSIGNMENT WAS MADE IN THE ORIGINAL STRUCTURE DETERMINATION AT 1.9 ANGSTROMS (PRESENTED IN PROTEIN DATA BANK ENTRY 1GPB) AND CARRIED THROUGH TO THE OTHER ENTRIES. ILE IS MORE CONSISTENT WITH THE ELECTRON DENSITY. HOWEVER, THE RESOLUTION AT 1.9 ANGSTROMS DOES NOT ALLOW A DEFINITIVE ASSIGNMENT. |
- Components
Components
| #1: Protein | Mass: 97291.203 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  | ||||||
|---|---|---|---|---|---|---|---|
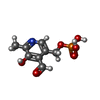
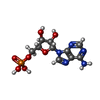
| #2: Chemical | ChemComp-PLP / | ||||||
| #3: Chemical | | #4: Water | ChemComp-HOH / | Has protein modification | N | Sequence details | RESIDUE 380 IS LEU IN THE SEQUENCE (K.NAKANO,P.K.HWANG, R.J.FLETTERICK, FEBS LETT., V. 204, P. 283, ...RESIDUE 380 IS LEU IN THE SEQUENCE (K.NAKANO,P.K.HWANG, R.J.FLETTERICK | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION X-RAY DIFFRACTION |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.47 Å3/Da / Density % sol: 50.13 % | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | *PLUS Temperature: 16 ℃ / Method: batch method / Details: took Johnson et al., 1974 from original paper | ||||||||||||||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Reflection | *PLUS Highest resolution: 2.2 Å / Num. obs: 36295 / % possible obs: 80 % / Num. measured all: 165007 / Rmerge(I) obs: 0.08 |
|---|
- Processing
Processing
| Software | Name:  X-PLOR / Classification: refinement X-PLOR / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Rfactor Rwork: 0.206 / Highest resolution: 2.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Highest resolution: 2.2 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Software | *PLUS Name:  X-PLOR / Classification: refinement X-PLOR / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement | *PLUS Num. reflection obs: 36167 / Rfactor Rwork: 0.206 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS Type: x_angle_d / Dev ideal: 3.6 |
 Movie
Movie Controller
Controller
























 PDBj
PDBj