+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8eoi | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of a human EMC:human Cav1.2 channel complex in GDN detergent | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | MEMBRANE PROTEIN / endoplasmic reticulum membrane protein complex / voltage-gated calcium channel / holdase / biogenesis | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報extrinsic component of endoplasmic reticulum membrane / EMC complex / : / positive regulation of high voltage-gated calcium channel activity / omegasome membrane / protein insertion into ER membrane by stop-transfer membrane-anchor sequence / voltage-gated calcium channel activity involved in AV node cell action potential / voltage-gated calcium channel activity involved in cardiac muscle cell action potential / immune system development / magnesium ion transport ...extrinsic component of endoplasmic reticulum membrane / EMC complex / : / positive regulation of high voltage-gated calcium channel activity / omegasome membrane / protein insertion into ER membrane by stop-transfer membrane-anchor sequence / voltage-gated calcium channel activity involved in AV node cell action potential / voltage-gated calcium channel activity involved in cardiac muscle cell action potential / immune system development / magnesium ion transport / positive regulation of adenylate cyclase activity / membrane depolarization during atrial cardiac muscle cell action potential / calcium ion transmembrane transport via high voltage-gated calcium channel / tail-anchored membrane protein insertion into ER membrane / Miscellaneous transport and binding events / Phase 2 - plateau phase / cobalt ion transmembrane transporter activity / ferrous iron transmembrane transporter activity / high voltage-gated calcium channel activity / membrane depolarization during AV node cell action potential / copper ion transport / cardiac conduction / L-type voltage-gated calcium channel complex / magnesium ion transmembrane transporter activity / membrane depolarization during cardiac muscle cell action potential / positive regulation of muscle contraction / cell communication by electrical coupling involved in cardiac conduction / regulation of ventricular cardiac muscle cell action potential / NCAM1 interactions / camera-type eye development / cardiac muscle cell action potential involved in contraction / embryonic forelimb morphogenesis / calcium ion transport into cytosol / voltage-gated calcium channel complex / Phase 0 - rapid depolarisation / alpha-actinin binding / regulation of heart rate by cardiac conduction / calcium ion import across plasma membrane / autophagosome assembly / RHOA GTPase cycle / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / voltage-gated calcium channel activity / positive regulation of endothelial cell proliferation / positive regulation of endothelial cell migration / calcium channel regulator activity / Regulation of insulin secretion / postsynaptic density membrane / calcium ion transmembrane transport / Z disc / positive regulation of angiogenesis / Adrenaline,noradrenaline inhibits insulin secretion / heart development / positive regulation of cytosolic calcium ion concentration / carbohydrate binding / early endosome membrane / angiogenesis / perikaryon / early endosome / calmodulin binding / postsynaptic density / cilium / Golgi membrane / apoptotic process / dendrite / endoplasmic reticulum membrane / endoplasmic reticulum / Golgi apparatus / protein-containing complex / extracellular region / nucleoplasm / metal ion binding / membrane / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Chen, Z. / Mondal, A. / Abderemane-Ali, F. / Minor, D.L. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: EMC chaperone-Ca structure reveals an ion channel assembly intermediate. 著者: Zhou Chen / Abhisek Mondal / Fayal Abderemane-Ali / Seil Jang / Sangeeta Niranjan / José L Montaño / Balyn W Zaro / Daniel L Minor /  要旨: Voltage-gated ion channels (VGICs) comprise multiple structural units, the assembly of which is required for function. Structural understanding of how VGIC subunits assemble and whether chaperone ...Voltage-gated ion channels (VGICs) comprise multiple structural units, the assembly of which is required for function. Structural understanding of how VGIC subunits assemble and whether chaperone proteins are required is lacking. High-voltage-activated calcium channels (Cas) are paradigmatic multisubunit VGICs whose function and trafficking are powerfully shaped by interactions between pore-forming Ca1 or Ca2 Caα (ref. ), and the auxiliary Caβ and Caαδ subunits. Here we present cryo-electron microscopy structures of human brain and cardiac Ca1.2 bound with Caβ to a chaperone-the endoplasmic reticulum membrane protein complex (EMC)-and of the assembled Ca1.2-Caβ-Caαδ-1 channel. These structures provide a view of an EMC-client complex and define EMC sites-the transmembrane (TM) and cytoplasmic (Cyto) docks; interaction between these sites and the client channel causes partial extraction of a pore subunit and splays open the Caαδ-interaction site. The structures identify the Caαδ-binding site for gabapentinoid anti-pain and anti-anxiety drugs, show that EMC and Caαδ interactions with the channel are mutually exclusive, and indicate that EMC-to-Caαδ hand-off involves a divalent ion-dependent step and Ca1.2 element ordering. Disruption of the EMC-Ca complex compromises Ca function, suggesting that the EMC functions as a channel holdase that facilitates channel assembly. Together, the structures reveal a Ca assembly intermediate and EMC client-binding sites that could have wide-ranging implications for the biogenesis of VGICs and other membrane proteins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8eoi.cif.gz 8eoi.cif.gz | 662.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8eoi.ent.gz pdb8eoi.ent.gz | 524.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8eoi.json.gz 8eoi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8eoi_validation.pdf.gz 8eoi_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8eoi_full_validation.pdf.gz 8eoi_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  8eoi_validation.xml.gz 8eoi_validation.xml.gz | 92.1 KB | 表示 | |
| CIF形式データ |  8eoi_validation.cif.gz 8eoi_validation.cif.gz | 142 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/eo/8eoi https://data.pdbj.org/pub/pdb/validation_reports/eo/8eoi ftp://data.pdbj.org/pub/pdb/validation_reports/eo/8eoi ftp://data.pdbj.org/pub/pdb/validation_reports/eo/8eoi | HTTPS FTP |
-関連構造データ
| 関連構造データ |  28376MC  8eogC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-ER membrane protein complex subunit ... , 9種, 9分子 ABCEFGHID
| #1: タンパク質 | 分子量: 109598.438 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC1, KIAA0090, PSEC0263 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC1, KIAA0090, PSEC0263 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q8N766 Homo sapiens (ヒト) / 参照: UniProt: Q8N766 |
|---|---|
| #2: タンパク質 | 分子量: 34250.797 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC2, KIAA0103, TTC35 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC2, KIAA0103, TTC35 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q15006 Homo sapiens (ヒト) / 参照: UniProt: Q15006 |
| #3: タンパク質 | 分子量: 29722.598 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC3, TMEM111 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC3, TMEM111 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q9P0I2 Homo sapiens (ヒト) / 参照: UniProt: Q9P0I2 |
| #4: タンパク質 | 分子量: 11425.147 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MMGT1, EMC5, TMEM32 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MMGT1, EMC5, TMEM32 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q8N4V1 Homo sapiens (ヒト) / 参照: UniProt: Q8N4V1 |
| #5: タンパク質 | 分子量: 11014.019 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC6, TMEM93 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC6, TMEM93 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q9BV81 Homo sapiens (ヒト) / 参照: UniProt: Q9BV81 |
| #6: タンパク質 | 分子量: 13151.044 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC7, C11orf3, C15orf24, HT022, UNQ905/PRO1926 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC7, C11orf3, C15orf24, HT022, UNQ905/PRO1926 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q9NPA0 Homo sapiens (ヒト) / 参照: UniProt: Q9NPA0 |
| #7: タンパク質 | 分子量: 23578.764 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) Homo sapiens (ヒト)遺伝子: EMC8, C16orf2, C16orf4, COX4AL, COX4NB, FAM158B, NOC4 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: O43402 Homo sapiens (ヒト) / 参照: UniProt: O43402 |
| #8: タンパク質 | 分子量: 17003.912 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC10, C19orf63, INM02, UNQ764/PRO1556 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC10, C19orf63, INM02, UNQ764/PRO1556 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q5UCC4 Homo sapiens (ヒト) / 参照: UniProt: Q5UCC4 |
| #11: タンパク質 | 分子量: 18790.051 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: EMC4, TMEM85, HSPC184, PIG17 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: EMC4, TMEM85, HSPC184, PIG17 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q5J8M3 Homo sapiens (ヒト) / 参照: UniProt: Q5J8M3 |
-Voltage-dependent L-type calcium channel subunit ... , 2種, 2分子 KJ
| #9: タンパク質 | 分子量: 176678.766 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CACNA1C, CACH2, CACN2, CACNL1A1, CCHL1A1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CACNA1C, CACH2, CACN2, CACNL1A1, CCHL1A1 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q13936 Homo sapiens (ヒト) / 参照: UniProt: Q13936 |
|---|---|
| #10: タンパク質 | 分子量: 36692.055 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 参照: UniProt: P54286 Homo sapiens (ヒト) / 参照: UniProt: P54286 |
-糖 , 2種, 4分子 
| #12: 多糖 | | #13: 糖 | ChemComp-NAG / | |
|---|
-非ポリマー , 1種, 1分子 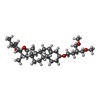
| #14: 化合物 | ChemComp-9Z9 / ( |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||||||||||||
| 試料 | 濃度: 1.7 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1700 nm / 最小 デフォーカス(公称値): 900 nm / Cs: 2.7 mm |
| 撮影 | 電子線照射量: 46 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 487067 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj




















