+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8enm | |||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the high pH nitrogenase MoFe-protein under non-turnover conditions | |||||||||||||||||||||||||||||||||||||||
 要素 要素 | (Nitrogenase molybdenum-iron protein ...) x 2 | |||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / nitrogenase / nitrogen fixation / reductase / MoFe | |||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報molybdenum-iron nitrogenase complex / nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / ATP binding / metal ion binding 類似検索 - 分子機能 | |||||||||||||||||||||||||||||||||||||||
| 生物種 |  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) | |||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.14 Å | |||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Warmack, R.A. / Maggiolo, A.O. / Rees, D.C. | |||||||||||||||||||||||||||||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| |||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Structural consequences of turnover-induced homocitrate loss in nitrogenase. 著者: Rebeccah A Warmack / Ailiena O Maggiolo / Andres Orta / Belinda B Wenke / James B Howard / Douglas C Rees /  要旨: Nitrogenase catalyzes the ATP-dependent reduction of dinitrogen to ammonia during the process of biological nitrogen fixation that is essential for sustaining life. The active site FeMo-cofactor ...Nitrogenase catalyzes the ATP-dependent reduction of dinitrogen to ammonia during the process of biological nitrogen fixation that is essential for sustaining life. The active site FeMo-cofactor contains a [7Fe:1Mo:9S:1C] metallocluster coordinated with an R-homocitrate (HCA) molecule. Here, we establish through single particle cryoEM and chemical analysis of two forms of the Azotobacter vinelandii MoFe-protein - a high pH turnover inactivated species and a ∆NifV variant that cannot synthesize HCA - that loss of HCA is coupled to α-subunit domain and FeMo-cofactor disordering, and formation of a histidine coordination site. We further find a population of the ∆NifV variant complexed to an endogenous protein identified through structural and proteomic approaches as the uncharacterized protein NafT. Recognition by endogenous NafT demonstrates the physiological relevance of the HCA-compromised form, perhaps for cofactor insertion or repair. Our results point towards a dynamic active site in which HCA plays a role in enabling nitrogenase catalysis by facilitating activation of the FeMo-cofactor from a relatively stable form to a state capable of reducing dinitrogen under ambient conditions. | |||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8enm.cif.gz 8enm.cif.gz | 441.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8enm.ent.gz pdb8enm.ent.gz | 352.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8enm.json.gz 8enm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8enm_validation.pdf.gz 8enm_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8enm_full_validation.pdf.gz 8enm_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  8enm_validation.xml.gz 8enm_validation.xml.gz | 71.9 KB | 表示 | |
| CIF形式データ |  8enm_validation.cif.gz 8enm_validation.cif.gz | 120.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/en/8enm https://data.pdbj.org/pub/pdb/validation_reports/en/8enm ftp://data.pdbj.org/pub/pdb/validation_reports/en/8enm ftp://data.pdbj.org/pub/pdb/validation_reports/en/8enm | HTTPS FTP |
-関連構造データ
| 関連構造データ |  28273MC  8crsC  8dbxC  8enlC  8ennC  8enoC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Nitrogenase molybdenum-iron protein ... , 2種, 4分子 ACBD
| #1: タンパク質 | 分子量: 55363.043 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Azotobacter vinelandii (窒素固定) / 参照: UniProt: P07328, nitrogenase Azotobacter vinelandii (窒素固定) / 参照: UniProt: P07328, nitrogenase#2: タンパク質 | 分子量: 59535.879 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Azotobacter vinelandii (窒素固定) / 参照: UniProt: P07329, nitrogenase Azotobacter vinelandii (窒素固定) / 参照: UniProt: P07329, nitrogenase |
|---|
-非ポリマー , 5種, 1701分子 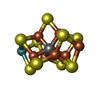
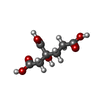







| #3: 化合物 | | #4: 化合物 | #5: 化合物 | #6: 化合物 | #7: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | N |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Heterotetrameric nitrogenase MoFe-protein / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 緩衝液 | pH: 7.8 |
| 試料 | 濃度: 4.75 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): -3000 nm / 最小 デフォーカス(公称値): -800 nm |
| 撮影 | 電子線照射量: 60 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア | 名称: PHENIX / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.14 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 331604 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj




