+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7vyq | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Short chain dehydrogenase (SCR) cryoEM structure with NADP and ethyl 4-chloroacetoacetate | |||||||||
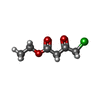
 要素 要素 | Carbonyl Reductase | |||||||||
 キーワード キーワード | OXIDOREDUCTASE / Rossman fold / tetramer / tag-free / wild type with NADPH | |||||||||
| 機能・相同性 | oxidoreductase activity, acting on NAD(P)H, oxygen as acceptor / 酸化還元酵素; CH-OHの結合に対し酸化酵素として働く; NAD又はNADPを用いる / oxidoreductase activity, acting on the CH-OH group of donors, NAD or NADP as acceptor / Enoyl-(Acyl carrier protein) reductase / Short-chain dehydrogenase/reductase SDR / NAD(P)-binding domain superfamily / ethyl 4-chloranyl-3-oxidanylidene-butanoate / NADP NICOTINAMIDE-ADENINE-DINUCLEOTIDE PHOSPHATE / Carbonyl Reductase 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Candida parapsilosis (酵母) Candida parapsilosis (酵母) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.13 Å | |||||||||
 データ登録者 データ登録者 | Li, Y.H. / Zhang, R.Z. / Wang, C. / Forouhar, F. / Clarke, O. / Vorobiev, S. / Singh, S. / Montelione, G.T. / Szyperski, T. / Xu, Y. / Hunt, J.F. | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2022 ジャーナル: EMBO J / 年: 2022タイトル: Oligomeric interactions maintain active-site structure in a noncooperative enzyme family. 著者: Yaohui Li / Rongzhen Zhang / Chi Wang / Farhad Forouhar / Oliver B Clarke / Sergey Vorobiev / Shikha Singh / Gaetano T Montelione / Thomas Szyperski / Yan Xu / John F Hunt /   要旨: The evolutionary benefit accounting for widespread conservation of oligomeric structures in proteins lacking evidence of intersubunit cooperativity remains unclear. Here, crystal and cryo-EM ...The evolutionary benefit accounting for widespread conservation of oligomeric structures in proteins lacking evidence of intersubunit cooperativity remains unclear. Here, crystal and cryo-EM structures, and enzymological data, demonstrate that a conserved tetramer interface maintains the active-site structure in one such class of proteins, the short-chain dehydrogenase/reductase (SDR) superfamily. Phylogenetic comparisons support a significantly longer polypeptide being required to maintain an equivalent active-site structure in the context of a single subunit. Oligomerization therefore enhances evolutionary fitness by reducing the metabolic cost of enzyme biosynthesis. The large surface area of the structure-stabilizing oligomeric interface yields a synergistic gain in fitness by increasing tolerance to activity-enhancing yet destabilizing mutations. We demonstrate that two paralogous SDR superfamily enzymes with different specificities can form mixed heterotetramers that combine their individual enzymological properties. This suggests that oligomerization can also diversify the functions generated by a given metabolic investment, enhancing the fitness advantage provided by this architectural strategy. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7vyq.cif.gz 7vyq.cif.gz | 404.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7vyq.ent.gz pdb7vyq.ent.gz | 337.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7vyq.json.gz 7vyq.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7vyq_validation.pdf.gz 7vyq_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7vyq_full_validation.pdf.gz 7vyq_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  7vyq_validation.xml.gz 7vyq_validation.xml.gz | 36.7 KB | 表示 | |
| CIF形式データ |  7vyq_validation.cif.gz 7vyq_validation.cif.gz | 51.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vy/7vyq https://data.pdbj.org/pub/pdb/validation_reports/vy/7vyq ftp://data.pdbj.org/pub/pdb/validation_reports/vy/7vyq ftp://data.pdbj.org/pub/pdb/validation_reports/vy/7vyq | HTTPS FTP |
-関連構造データ
| 関連構造データ |  32211MC  7dldC  7dllC  7dlmC  7dmgC  7dn1C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 電子顕微鏡画像生データ |  EMPIAR-10872 (タイトル: Oligomeric interactions maintain active-site structure in a non-cooperative enzyme family EMPIAR-10872 (タイトル: Oligomeric interactions maintain active-site structure in a non-cooperative enzyme familyData size: 902.0 Data #1: Native-SCR-tetramer-frames [micrographs - multiframe]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 30204.873 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Candida parapsilosis (酵母) / 遺伝子: DQ675534 / 発現宿主: Candida parapsilosis (酵母) / 遺伝子: DQ675534 / 発現宿主:  参照: UniProt: B2KJ46, 酸化還元酵素; CH-OHの結合に対し酸化酵素として働く; NAD又はNADPを用いる #2: 化合物 | ChemComp-NAP / #3: 化合物 | ChemComp-83I / 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Ternary complex of SCR with NADP and ethyl 4-chloroacetoacetate タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:  Candida parapsilosis (酵母) Candida parapsilosis (酵母) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 6 |
| 試料 | 濃度: 3 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2170 nm / 最小 デフォーカス(公称値): 1370 nm |
| 撮影 | 平均露光時間: 2.5 sec. / 電子線照射量: 56.15 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 2885 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: dev_4376: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: D2 (2回x2回 2面回転対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.13 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 104278 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | B value: 177 / 空間: REAL | ||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 7DLM Accession code: 7DLM / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj