+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7qrf | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the dimeric complex between precursor membrane ectodomain (prM) and envelope protein ectodomain (E) from tick-borne encephalitis virus | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | VIRAL PROTEIN / class II fusion envelope protein / precursor membrane protein / chaperone / flavivirus maturation / trans-golgi acid pH | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報flavivirin / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / viral capsid / double-stranded RNA binding / nucleoside-triphosphate phosphatase / mRNA (guanine-N7)-methyltransferase / methyltransferase cap1 / clathrin-dependent endocytosis of virus by host cell / methyltransferase cap1 activity ...flavivirin / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT2 activity / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / viral capsid / double-stranded RNA binding / nucleoside-triphosphate phosphatase / mRNA (guanine-N7)-methyltransferase / methyltransferase cap1 / clathrin-dependent endocytosis of virus by host cell / methyltransferase cap1 activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / RNA helicase activity / protein dimerization activity / host cell perinuclear region of cytoplasm / host cell endoplasmic reticulum membrane / symbiont-mediated suppression of host innate immune response / RNA helicase / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / symbiont-mediated activation of host autophagy / serine-type endopeptidase activity / RNA-directed RNA polymerase / viral RNA genome replication / RNA-directed RNA polymerase activity / fusion of virus membrane with host endosome membrane / viral envelope / virion attachment to host cell / host cell nucleus / virion membrane / structural molecule activity / ATP hydrolysis activity / proteolysis / extracellular region / ATP binding / metal ion binding / membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Tick-borne encephalitis virus (ダニ媒介脳炎ウイルス) Tick-borne encephalitis virus (ダニ媒介脳炎ウイルス) | ||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.28 Å 分子置換 / 解像度: 2.28 Å | ||||||||||||
 データ登録者 データ登録者 | Vaney, M.C. / Rouvinski, A. / Rey, F.A. | ||||||||||||
| 資金援助 |  フランス, 3件 フランス, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Evolution and activation mechanism of the flavivirus class II membrane-fusion machinery. 著者: Vaney, M.C. / Dellarole, M. / Duquerroy, S. / Medits, I. / Tsouchnikas, G. / Rouvinski, A. / England, P. / Stiasny, K. / Heinz, F.X. / Rey, F.A. #1:  ジャーナル: Nature / 年: 1995 ジャーナル: Nature / 年: 1995タイトル: The envelope glycoprotein from tick-borne encephalitis virus at 2 A resolution. 著者: Rey, F.A. / Heinz, F.X. / Mandl, C. / Kunz, C. / Harrison, S.C. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7qrf.cif.gz 7qrf.cif.gz | 205.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7qrf.ent.gz pdb7qrf.ent.gz | 161.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7qrf.json.gz 7qrf.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7qrf_validation.pdf.gz 7qrf_validation.pdf.gz | 700.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7qrf_full_validation.pdf.gz 7qrf_full_validation.pdf.gz | 703.7 KB | 表示 | |
| XML形式データ |  7qrf_validation.xml.gz 7qrf_validation.xml.gz | 18.9 KB | 表示 | |
| CIF形式データ |  7qrf_validation.cif.gz 7qrf_validation.cif.gz | 25.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qr/7qrf https://data.pdbj.org/pub/pdb/validation_reports/qr/7qrf ftp://data.pdbj.org/pub/pdb/validation_reports/qr/7qrf ftp://data.pdbj.org/pub/pdb/validation_reports/qr/7qrf | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質 , 2種, 2分子 AD
| #1: タンパク質 | 分子量: 47867.855 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: The N-terminal end of E (Molecule 1) is linked to the C-terminal of ectodomain prM (Molecule 3) by a linker of 14 residues (GGGGENLYFQGGGG). This linker of 14 residues is only described in ...詳細: The N-terminal end of E (Molecule 1) is linked to the C-terminal of ectodomain prM (Molecule 3) by a linker of 14 residues (GGGGENLYFQGGGG). This linker of 14 residues is only described in the sequence of E (Molecule 1) at its N-terminal. For purification, at the C-terminal of E it is added an enterokinase site with a dstrep-tag sequence : (GPFEDDDDKAGWSHPQFEKGGGSGGGSGGGSWSHPQFEK). 由来: (組換発現)  Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス) Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス)株: Neudoerfl / プラスミド: PT389 / Cell (発現宿主): SCHNEIDER 2 発現宿主:  参照: UniProt: P14336 |
|---|---|
| #3: タンパク質 | 分子量: 15290.941 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: The C-terminal end of prM (Molecule 3) is linked to the N-terminal of E (Molecule 1) by a linker of 14 residues (GGGGENLYFQGGGG). This linker is described in the sequence of E (Molecule 1). ...詳細: The C-terminal end of prM (Molecule 3) is linked to the N-terminal of E (Molecule 1) by a linker of 14 residues (GGGGENLYFQGGGG). This linker is described in the sequence of E (Molecule 1). The furin site is deleted from one amino acid (Arginine). Intact furin site : ...RTRRSVL... Mutated furin site : ...RTRSVL... 由来: (組換発現)  Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス) Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス)株: Neudoerfl / プラスミド: PT389 / Cell (発現宿主): SCHNEIDER 2 発現宿主:  参照: UniProt: P14336 |
-タンパク質・ペプチド , 1種, 1分子 C
| #2: タンパク質・ペプチド | 分子量: 443.539 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: This peptide should be part of the M ectodomain but we were unable to attribute the true sequence. 由来: (組換発現)  Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス) Tick-borne encephalitis virus (WESTERN SUBTYPE) (ウイルス)株: NEUDOERFL / プラスミド: PT389 / Cell (発現宿主): SCHNEIDER 2 発現宿主:  |
|---|
-非ポリマー , 4種, 84分子 
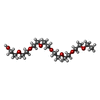





| #4: 化合物 | ChemComp-SO4 / | ||
|---|---|---|---|
| #5: 化合物 | ChemComp-PE4 / | ||
| #6: 化合物 | ChemComp-EDO / #7: 水 | ChemComp-HOH / | |
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.97 Å3/Da / 溶媒含有率: 58.63 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法 / pH: 3.5 詳細: 0.2M Li(SO4), 0.1M Na citrate pH 3.5, 28% (v/v) PEG 400 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-1 / 波長: 0.97934 Å / ビームライン: ID23-1 / 波長: 0.97934 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2014年2月14日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97934 Å / 相対比: 1 |
| 反射 | 解像度: 2.28→49 Å / Num. obs: 28985 / % possible obs: 95 % / 冗長度: 19.5 % / CC1/2: 0.998 / Rmerge(I) obs: 0.096 / Rpim(I) all: 0.023 / Rrim(I) all: 0.099 / Net I/σ(I): 19.8 |
| 反射 シェル | 解像度: 2.28→2.435 Å / Rmerge(I) obs: 2.623 / Num. unique obs: 1449 / CC1/2: 0.323 / Rpim(I) all: 0.891 / Rrim(I) all: 2.699 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1SVB, 3C5X 解像度: 2.28→28.42 Å / Cor.coef. Fo:Fc: 0.96 / Cor.coef. Fo:Fc free: 0.939 / SU R Cruickshank DPI: 0.222 / 交差検証法: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.217 / SU Rfree Blow DPI: 0.18 / SU Rfree Cruickshank DPI: 0.183 詳細: The BUSTER refinement was done against the STARANISO corrected intensity from anisotropy. This is the reason why, in the last shell of resolution, the completness is 7% while the working ...詳細: The BUSTER refinement was done against the STARANISO corrected intensity from anisotropy. This is the reason why, in the last shell of resolution, the completness is 7% while the working Rfactor is higher than the free Rfactor. All the refinement stastitics introduced here are from the STARANISO statistics output.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 178.25 Å2 / Biso mean: 80.83 Å2 / Biso min: 44.08 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.3 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 2.28→28.42 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.28→2.36 Å / Rfactor Rfree error: 0 / Total num. of bins used: 15
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj






