| 登録情報 | データベース: PDB / ID: 7orc
|
|---|
| タイトル | Human Aldehyde Oxidase in complex with Raloxifene |
|---|
 要素 要素 | Aldehyde oxidase |
|---|
 キーワード キーワード | OXIDOREDUCTASE / Human Aldehyde Oxidase / Complex / Inhibitor |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
酸化還元酵素; メチレン基、メチン基に作用する; 酸素を電子受容体とする / aldehyde oxidase / aldehyde oxidase activity / Vitamin B6 activation to pyridoxal phosphate / molybdopterin cofactor binding / intercellular bridge / xenobiotic metabolic process / FAD binding / lipid metabolic process / 2 iron, 2 sulfur cluster binding ...酸化還元酵素; メチレン基、メチン基に作用する; 酸素を電子受容体とする / aldehyde oxidase / aldehyde oxidase activity / Vitamin B6 activation to pyridoxal phosphate / molybdopterin cofactor binding / intercellular bridge / xenobiotic metabolic process / FAD binding / lipid metabolic process / 2 iron, 2 sulfur cluster binding / NAD binding / flavin adenine dinucleotide binding / microtubule cytoskeleton / nuclear body / iron ion binding / protein homodimerization activity / extracellular exosome / identical protein binding / cytosol類似検索 - 分子機能 Aldehyde oxidase / Oxidoreductase, molybdopterin binding site / Eukaryotic molybdopterin oxidoreductases signature. / CO dehydrogenase flavoprotein C-terminal domain / Molybdopterin dehydrogenase, FAD-binding / CO dehydrogenase flavoprotein, C-terminal / CO dehydrogenase flavoprotein, C-terminal domain superfamily / FAD binding domain in molybdopterin dehydrogenase / CO dehydrogenase flavoprotein C-terminal domain / Aldehyde oxidase/xanthine dehydrogenase ...Aldehyde oxidase / Oxidoreductase, molybdopterin binding site / Eukaryotic molybdopterin oxidoreductases signature. / CO dehydrogenase flavoprotein C-terminal domain / Molybdopterin dehydrogenase, FAD-binding / CO dehydrogenase flavoprotein, C-terminal / CO dehydrogenase flavoprotein, C-terminal domain superfamily / FAD binding domain in molybdopterin dehydrogenase / CO dehydrogenase flavoprotein C-terminal domain / Aldehyde oxidase/xanthine dehydrogenase / Aldehyde oxidase and xanthine dehydrogenase, a/b hammerhead domain / Aldehyde oxidase/xanthine dehydrogenase, a/b hammerhead / [2Fe-2S]-binding / Aldehyde oxidase/xanthine dehydrogenase, first molybdopterin binding domain / Aldehyde oxidase/xanthine dehydrogenase, a/b hammerhead superfamily / [2Fe-2S]-binding domain superfamily / Aldehyde oxidase/xanthine dehydrogenase, molybdopterin binding domain superfamily / Aldehyde oxidase/xanthine dehydrogenase, second molybdopterin binding domain / [2Fe-2S] binding domain / Molybdopterin cofactor-binding domain / Molybdopterin cofactor-binding domain / Aldehyde oxidase and xanthine dehydrogenase, a/b hammerhead domain / FAD-binding, type PCMH, subdomain 1 / 2Fe-2S ferredoxin, iron-sulphur binding site / 2Fe-2S ferredoxin-type iron-sulfur binding region signature. / FAD-binding domain, PCMH-type / PCMH-type FAD-binding domain profile. / FAD-binding, type PCMH, subdomain 2 / FAD-binding, type PCMH-like superfamily / 2Fe-2S iron-sulfur cluster binding domain / Beta-grasp domain superfamily / 2Fe-2S ferredoxin-type iron-sulfur binding domain profile. / 2Fe-2S ferredoxin-type iron-sulfur binding domain / 2Fe-2S ferredoxin-like superfamily類似検索 - ドメイン・相同性 FLAVIN-ADENINE DINUCLEOTIDE / FE2/S2 (INORGANIC) CLUSTER / MALONATE ION / DIOXOTHIOMOLYBDENUM(VI) ION / Chem-MTE / RALOXIFENE / Aldehyde oxidase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.7 Å 分子置換 / 解像度: 2.7 Å |
|---|
 データ登録者 データ登録者 | Mota, C. / Coelho, C. / Santos Silva, T. / Romao, M.J. |
|---|
| 資金援助 |  ポルトガル, 1件 ポルトガル, 1件 | 組織 | 認可番号 | 国 |
|---|
| Fundacao para a Ciencia e a Tecnologia | PTDC/BBB-BEP/1185/2014 |  ポルトガル ポルトガル |
|
|---|
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2021 ジャーナル: J.Med.Chem. / 年: 2021
タイトル: Interrogating the Inhibition Mechanisms of Human Aldehyde Oxidase by X-ray Crystallography and NMR Spectroscopy: The Raloxifene Case.
著者: Mota, C. / Diniz, A. / Coelho, C. / Santos-Silva, T. / Esmaeeli, M. / Leimkuhler, S. / Cabrita, E.J. / Marcelo, F. / Romao, M.J. |
|---|
| 履歴 | | 登録 | 2021年6月5日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2021年9月1日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年9月22日 | Group: Data collection / Database references
カテゴリ: citation / citation_author / pdbx_database_proc
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation_author.identifier_ORCID |
|---|
| 改定 1.2 | 2024年1月31日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.7 Å
分子置換 / 解像度: 2.7 Å  データ登録者
データ登録者 ポルトガル, 1件
ポルトガル, 1件  引用
引用 ジャーナル: J.Med.Chem. / 年: 2021
ジャーナル: J.Med.Chem. / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7orc.cif.gz
7orc.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7orc.ent.gz
pdb7orc.ent.gz PDB形式
PDB形式 7orc.json.gz
7orc.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/or/7orc
https://data.pdbj.org/pub/pdb/validation_reports/or/7orc ftp://data.pdbj.org/pub/pdb/validation_reports/or/7orc
ftp://data.pdbj.org/pub/pdb/validation_reports/or/7orc リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: AOX1, AO / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: AOX1, AO / 発現宿主: 

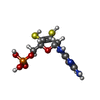


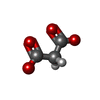








 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID30B / 波長: 0.9762 Å
/ ビームライン: ID30B / 波長: 0.9762 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj














