| 登録情報 | データベース: PDB / ID: 6z30
|
|---|
| タイトル | Human cation-independent mannose 6-phosphate/ IGF2 receptor domains 9-10 |
|---|
 要素 要素 | Cation-independent mannose-6-phosphate receptor |
|---|
 キーワード キーワード | SUGAR BINDING PROTEIN / Mannose 6-phosphate / Cation-independent mannose 6-phosphate receptor / Insulin-like growth factor 2 receptor / P-type lectin |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
clathrin coat / Retrograde transport at the Trans-Golgi-Network / response to tetrachloromethane / insulin-like growth factor receptor activity / retromer complex binding / insulin-like growth factor binding / insulin-like growth factor II binding / trans-Golgi network transport vesicle / host-mediated activation of viral process / retinoic acid binding ...clathrin coat / Retrograde transport at the Trans-Golgi-Network / response to tetrachloromethane / insulin-like growth factor receptor activity / retromer complex binding / insulin-like growth factor binding / insulin-like growth factor II binding / trans-Golgi network transport vesicle / host-mediated activation of viral process / retinoic acid binding / lysosomal transport / Golgi Associated Vesicle Biogenesis / nuclear envelope lumen / D-mannose binding / endocytic vesicle / G-protein alpha-subunit binding / animal organ regeneration / response to retinoic acid / transport vesicle / receptor-mediated endocytosis / secretory granule membrane / trans-Golgi network membrane / post-embryonic development / phosphoprotein binding / trans-Golgi network / clathrin-coated endocytic vesicle membrane / liver development / Cargo recognition for clathrin-mediated endocytosis / Clathrin-mediated endocytosis / late endosome / signaling receptor activity / spermatogenesis / early endosome / endosome membrane / endosome / positive regulation of apoptotic process / G protein-coupled receptor signaling pathway / Golgi membrane / focal adhesion / Neutrophil degranulation / perinuclear region of cytoplasm / enzyme binding / cell surface / Golgi apparatus / signal transduction / extracellular exosome / identical protein binding / membrane / plasma membrane類似検索 - 分子機能 Cation-independent mannose-6-phosphate receptor repeat / Cation-independent mannose-6-phosphate receptor repeat / Cation-independent mannose-6-phosphate receptor repeat / Cation-dependent Mannose-6-phosphate Receptor; Chain A / Mannose-6-phosphate receptor binding domain / Mannose-6-phosphate receptor binding domain superfamily / MRH domain / MRH domain profile. / Fibronectin type II domain / Fibronectin type II domain superfamily ...Cation-independent mannose-6-phosphate receptor repeat / Cation-independent mannose-6-phosphate receptor repeat / Cation-independent mannose-6-phosphate receptor repeat / Cation-dependent Mannose-6-phosphate Receptor; Chain A / Mannose-6-phosphate receptor binding domain / Mannose-6-phosphate receptor binding domain superfamily / MRH domain / MRH domain profile. / Fibronectin type II domain / Fibronectin type II domain superfamily / Fibronectin type II domain / Fibronectin type-II collagen-binding domain signature. / Fibronectin type-II collagen-binding domain profile. / Fibronectin type 2 domain / Kringle-like fold / Distorted Sandwich / Mainly Beta類似検索 - ドメイン・相同性 Cation-independent mannose-6-phosphate receptor類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.5 Å 分子置換 / 解像度: 1.5 Å |
|---|
 データ登録者 データ登録者 | Bochel, A.J. / Williams, C. / Crump, M.P. |
|---|
| 資金援助 |  英国, 3件 英国, 3件 | 組織 | 認可番号 | 国 |
|---|
| Biotechnology and Biological Sciences Research Council (BBSRC) | BB/J014400/1 |  英国 英国 | | Biotechnology and Biological Sciences Research Council (BBSRC) | BB/M009122/1 |  英国 英国 | | Biotechnology and Biological Sciences Research Council (BBSRC) | BB/L01386X/1 |  英国 英国 |
|
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2020 ジャーナル: Structure / 年: 2020
タイトル: Structure of the Human Cation-Independent Mannose 6-Phosphate/IGF2 Receptor Domains 7-11 Uncovers the Mannose 6-Phosphate Binding Site of Domain 9.
著者: Bochel, A.J. / Williams, C. / McCoy, A.J. / Hoppe, H.J. / Winter, A.J. / Nicholls, R.D. / Harlos, K. / Jones, E.Y. / Berger, I. / Hassan, A.B. / Crump, M.P. |
|---|
| 履歴 | | 登録 | 2020年5月19日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2020年8月19日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年9月16日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _citation_author.identifier_ORCID / _citation_author.name |
|---|
| 改定 1.2 | 2020年12月9日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.3 | 2024年5月1日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.4 | 2024年11月20日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.5 Å
分子置換 / 解像度: 1.5 Å  データ登録者
データ登録者 英国, 3件
英国, 3件  引用
引用 ジャーナル: Structure / 年: 2020
ジャーナル: Structure / 年: 2020 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6z30.cif.gz
6z30.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6z30.ent.gz
pdb6z30.ent.gz PDB形式
PDB形式 6z30.json.gz
6z30.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6z30_validation.pdf.gz
6z30_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6z30_full_validation.pdf.gz
6z30_full_validation.pdf.gz 6z30_validation.xml.gz
6z30_validation.xml.gz 6z30_validation.cif.gz
6z30_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/z3/6z30
https://data.pdbj.org/pub/pdb/validation_reports/z3/6z30 ftp://data.pdbj.org/pub/pdb/validation_reports/z3/6z30
ftp://data.pdbj.org/pub/pdb/validation_reports/z3/6z30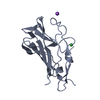

 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: IGF2R, MPRI
Homo sapiens (ヒト) / 遺伝子: IGF2R, MPRI
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I04 / 波長: 0.9795 Å
/ ビームライン: I04 / 波長: 0.9795 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj



