[English] 日本語
 Yorodumi
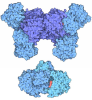
Yorodumi- PDB-6yw1: HIF prolyl hydroxylase 2 (PHD2/ EGLN1) in complex with 2OG and Ra... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6yw1 | ||||||
|---|---|---|---|---|---|---|---|
| Title | HIF prolyl hydroxylase 2 (PHD2/ EGLN1) in complex with 2OG and RaPID-derived silent allosteric cyclic peptide 3C (14-mer) | ||||||
 Components Components |
| ||||||
 Keywords Keywords | OXIDOREDUCTASE / NON-HEME DIOXYGENASE / IRON / 2-OXOGLUTARATE / HYPOXIA-INDUCIBLE FACTOR / HIF / HIF PROLYL HYDROXYLASE DOMAIN 2 / PHD2 / EGLN1 / OXYGENASE / HYPOXIA / DNA-BINDING / METAL-BINDING / TRANSCRIPTION / HELIX-LOOP-HELIX-BETA / DSBH / FACIAL TRIAD / CYTOPLASM / TRANSCRIPTION/EPIGENETIC REGULATION / SIGNALING / DEVELOPMENT / CELL STRUCTURE / BETA-HYDROXYLATION / TRANSCRIPTION ACTIVATOR/INHIBITOR / UBL CONJUGATION / POLYMORPHISM / VITAMIN C / ZINC-FINGER / FAMILIAL ERYTHROCYTOSIS / BREAST CANCER / TRANSCRIPTION COMPLEX | ||||||
| Function / homology |  Function and homology information Function and homology informationpeptidyl-proline 4-dioxygenase activity / hypoxia-inducible factor-proline dioxygenase activity / hypoxia-inducible factor-proline dioxygenase / negative regulation of hypoxia-inducible factor-1alpha signaling pathway / peptidyl-proline dioxygenase activity / regulation protein catabolic process at postsynapse / intracellular oxygen homeostasis / 2-oxoglutarate-dependent dioxygenase activity / regulation of modification of postsynaptic structure / labyrinthine layer development ...peptidyl-proline 4-dioxygenase activity / hypoxia-inducible factor-proline dioxygenase activity / hypoxia-inducible factor-proline dioxygenase / negative regulation of hypoxia-inducible factor-1alpha signaling pathway / peptidyl-proline dioxygenase activity / regulation protein catabolic process at postsynapse / intracellular oxygen homeostasis / 2-oxoglutarate-dependent dioxygenase activity / regulation of modification of postsynaptic structure / labyrinthine layer development / heart trabecula formation / cardiac muscle tissue morphogenesis / L-ascorbic acid binding / response to nitric oxide / ventricular septum morphogenesis / regulation of angiogenesis / enzyme inhibitor activity / regulation of neuron apoptotic process / ferrous iron binding / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / cellular response to hypoxia / intracellular iron ion homeostasis / response to hypoxia / postsynaptic density / intracellular membrane-bounded organelle / glutamatergic synapse / enzyme binding / positive regulation of transcription by RNA polymerase II / zinc ion binding / nucleus / cytosol / cytoplasm Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human)synthetic construct (others) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.46 Å MOLECULAR REPLACEMENT / Resolution: 1.46 Å | ||||||
 Authors Authors | Chowdhury, R. / Schofield, C.J. | ||||||
 Citation Citation |  Journal: Sci Rep / Year: 2020 Journal: Sci Rep / Year: 2020Title: Use of cyclic peptides to induce crystallization: case study with prolyl hydroxylase domain 2. Authors: Chowdhury, R. / Abboud, M.I. / McAllister, T.E. / Banerji, B. / Bhushan, B. / Sorensen, J.L. / Kawamura, A. / Schofield, C.J. #1:  Journal: Nat Commun / Year: 2016 Journal: Nat Commun / Year: 2016Title: Structural basis for oxygen degradation domain selectivity of the HIF prolyl hydroxylases. Authors: Chowdhury, R. / Leung, I.K. / Tian, Y.M. / Abboud, M.I. / Ge, W. / Domene, C. / Cantrelle, F.X. / Landrieu, I. / Hardy, A.P. / Pugh, C.W. / Ratcliffe, P.J. / Claridge, T.D. / Schofield, C.J. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6yw1.cif.gz 6yw1.cif.gz | 153.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6yw1.ent.gz pdb6yw1.ent.gz | 120.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6yw1.json.gz 6yw1.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/yw/6yw1 https://data.pdbj.org/pub/pdb/validation_reports/yw/6yw1 ftp://data.pdbj.org/pub/pdb/validation_reports/yw/6yw1 ftp://data.pdbj.org/pub/pdb/validation_reports/yw/6yw1 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  6yvwC  6yvxC  6yvzC  6yw0C  6yw2C  6yw3C  6yw4C  5l9rS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein / Protein/peptide , 2 types, 2 molecules AB
| #1: Protein | Mass: 26036.582 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Details: CATALYTIC DOMAIN (aa 181-407) / Source: (gene. exp.)  Homo sapiens (human) / Gene: EGLN1, C1orf12, PNAS-118, PNAS-137 / Plasmid: PET28A(+) / Production host: Homo sapiens (human) / Gene: EGLN1, C1orf12, PNAS-118, PNAS-137 / Plasmid: PET28A(+) / Production host:  References: UniProt: Q9GZT9, hypoxia-inducible factor-proline dioxygenase |
|---|---|
| #2: Protein/peptide | Mass: 1801.050 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) |
-Non-polymers , 4 types, 247 molecules 

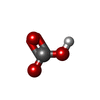




| #3: Chemical | ChemComp-MN / |
|---|---|
| #4: Chemical | ChemComp-AKG / |
| #5: Chemical | ChemComp-BCT / |
| #6: Water | ChemComp-HOH / |
-Details
| Has ligand of interest | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.53 Å3/Da / Density % sol: 51.41 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, sitting drop Details: Sample: 1.0 mM PHD2, 1.5 mM MnCl2, 2.0 mM compound, 1.0 mM 3C; Reservoir: 0.1 M Bis-Tris pH 6.5, 15.0 % PEG 3350, 0.002 M MnCl2; Sitting drop (300 nl), protein-to-well ratio, 1:2 |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I04 / Wavelength: 0.9795 Å / Beamline: I04 / Wavelength: 0.9795 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: DECTRIS PILATUS 6M-F / Detector: PIXEL / Date: May 8, 2017 / Details: MIRRORS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Monochromator: SI 111 / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.9795 Å / Relative weight: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 1.46→50 Å / Num. obs: 42887 / % possible obs: 100 % / Redundancy: 7.6 % / Biso Wilson estimate: 20.9 Å2 / CC1/2: 0.999 / Rmerge(I) obs: 0.06 / Rpim(I) all: 0.024 / Rrim(I) all: 0.064 / Χ2: 1.072 / Net I/σ(I): 28.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1 / % possible all: 100
|
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 5L9R Resolution: 1.46→40.297 Å / SU ML: 0.19 / Cross valid method: THROUGHOUT / σ(F): 1.34 / Phase error: 21.78 / Stereochemistry target values: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT MODEL / Bsol: 45.3 Å2 / ksol: 0.38 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 122.17 Å2 / Biso mean: 34.1839 Å2 / Biso min: 15.6 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.46→40.297 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / % reflection obs: 100 %
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller














 PDBj
PDBj