| 登録情報 | データベース: PDB / ID: 6yp8
|
|---|
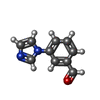
| タイトル | 14-3-3 sigma with RelA/p65 binding site pS45 and covalently bound TCF521-033 |
|---|
 要素 要素 | - 14-3-3 protein sigma
- p65pS45
|
|---|
 キーワード キーワード | PEPTIDE BINDING PROTEIN / covalent fragment / p65 / 1433 |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
prolactin signaling pathway / DEx/H-box helicases activate type I IFN and inflammatory cytokines production / NF-kappaB p50/p65 complex / toll-like receptor TLR6:TLR2 signaling pathway / IkBA variant leads to EDA-ID / positive regulation of Schwann cell differentiation / response to cobalamin / cellular response to peptidoglycan / ankyrin repeat binding / Regulated proteolysis of p75NTR ...prolactin signaling pathway / DEx/H-box helicases activate type I IFN and inflammatory cytokines production / NF-kappaB p50/p65 complex / toll-like receptor TLR6:TLR2 signaling pathway / IkBA variant leads to EDA-ID / positive regulation of Schwann cell differentiation / response to cobalamin / cellular response to peptidoglycan / ankyrin repeat binding / Regulated proteolysis of p75NTR / CLEC7A/inflammasome pathway / SUMOylation of immune response proteins / RIP-mediated NFkB activation via ZBP1 / postsynapse to nucleus signaling pathway / negative regulation of protein sumoylation / Interleukin-1 processing / nucleotide-binding oligomerization domain containing 2 signaling pathway / defense response to tumor cell / cellular response to interleukin-6 / actinin binding / response to UV-B / non-canonical NF-kappaB signal transduction / negative regulation of non-canonical NF-kappaB signal transduction / positive regulation of miRNA metabolic process / positive regulation of leukocyte adhesion to vascular endothelial cell / Regulation of NFE2L2 gene expression / interleukin-1-mediated signaling pathway / NF-kappaB complex / signal transduction involved in regulation of gene expression / vascular endothelial growth factor signaling pathway / toll-like receptor 4 signaling pathway / positive regulation of amyloid-beta formation / cellular response to hepatocyte growth factor stimulus / regulation of epidermal cell division / protein kinase C inhibitor activity / positive regulation of epidermal cell differentiation / keratinocyte development / keratinization / phosphate ion binding / positive regulation of T cell receptor signaling pathway / cellular response to lipoteichoic acid / regulation of cell-cell adhesion / response to muramyl dipeptide / TRAF6 mediated NF-kB activation / positive regulation of vascular endothelial growth factor production / cellular response to angiotensin / Transcriptional Regulation by VENTX / The NLRP3 inflammasome / cAMP/PKA signal transduction / Regulation of localization of FOXO transcription factors / keratinocyte proliferation / general transcription initiation factor binding / cellular response to interleukin-1 / phosphoserine residue binding / response to cAMP / hair follicle development / canonical NF-kappaB signal transduction / Activation of BAD and translocation to mitochondria / negative regulation of keratinocyte proliferation / neuropeptide signaling pathway / NF-kappaB binding / response to amino acid / establishment of skin barrier / negative regulation of protein localization to plasma membrane / cellular defense response / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / Purinergic signaling in leishmaniasis infection / RNA polymerase II core promoter sequence-specific DNA binding / NF-kB is activated and signals survival / negative regulation of protein kinase activity / negative regulation of stem cell proliferation / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / RHO GTPases activate PKNs / positive regulation of protein localization / response to muscle stretch / response to cytokine / positive regulation of interleukin-12 production / antiviral innate immune response / peptide binding / negative regulation of cytokine production involved in inflammatory response / CD209 (DC-SIGN) signaling / positive regulation of cell adhesion / response to interleukin-1 / negative regulation of insulin receptor signaling pathway / negative regulation of miRNA transcription / protein sequestering activity / negative regulation of innate immune response / response to progesterone / protein export from nucleus / negative regulation of angiogenesis / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest / Dectin-1 mediated noncanonical NF-kB signaling / release of cytochrome c from mitochondria / response to ischemia / Turbulent (oscillatory, disturbed) flow shear stress activates signaling by PIEZO1 and integrins in endothelial cells / animal organ morphogenesis / positive regulation of interleukin-1 beta production / positive regulation of protein export from nucleus / Activation of NF-kappaB in B cells類似検索 - 分子機能 Transcription factor RelA (p65) / NF-kappa-B/Dorsal / Rel homology domain, conserved site / NFkappaB IPT domain / NF-kappa-B/Rel/dorsal domain signature. / Rel homology domain (RHD), DNA-binding domain / Rel homology dimerisation domain / Rel homology DNA-binding domain / Rel homology dimerisation domain / NF-kappa-B/Rel/dorsal domain profile. ...Transcription factor RelA (p65) / NF-kappa-B/Dorsal / Rel homology domain, conserved site / NFkappaB IPT domain / NF-kappa-B/Rel/dorsal domain signature. / Rel homology domain (RHD), DNA-binding domain / Rel homology dimerisation domain / Rel homology DNA-binding domain / Rel homology dimerisation domain / NF-kappa-B/Rel/dorsal domain profile. / Rel homology domain (RHD), DNA-binding domain superfamily / ig-like, plexins, transcription factors / IPT domain / 14-3-3 protein sigma / 14-3-3 proteins signature 2. / 14-3-3 protein, conserved site / 14-3-3 proteins signature 1. / 14-3-3 protein / 14-3-3 homologues / 14-3-3 domain / 14-3-3 domain superfamily / 14-3-3 protein / p53-like transcription factor, DNA-binding / Immunoglobulin E-set / Immunoglobulin-like fold類似検索 - ドメイン・相同性 3-imidazol-1-ylbenzaldehyde / 14-3-3 protein sigma / Transcription factor p65類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å |
|---|
 データ登録者 データ登録者 | Wolter, M. / Ottmann, C. |
|---|
| 資金援助 | European Union, 1件 | 組織 | 認可番号 | 国 |
|---|
| European Commission | 675179 | European Union |
|
|---|
 引用 引用 |  ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2020 ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2020
タイトル: Fragment-Based Stabilizers of Protein-Protein Interactions through Imine-Based Tethering.
著者: Wolter, M. / Valenti, D. / Cossar, P.J. / Levy, L.M. / Hristeva, S. / Genski, T. / Hoffmann, T. / Brunsveld, L. / Tzalis, D. / Ottmann, C. |
|---|
| 履歴 | | 登録 | 2020年4月15日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2020年9月23日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年10月7日 | Group: Database references / カテゴリ: citation / citation_author / Item: _citation.title / _citation_author.name |
|---|
| 改定 1.2 | 2020年12月16日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.3 | 2024年1月24日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.4 | 2024年10月23日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 1.8 Å
分子置換 / 解像度: 1.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2020
ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2020 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6yp8.cif.gz
6yp8.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6yp8.ent.gz
pdb6yp8.ent.gz PDB形式
PDB形式 6yp8.json.gz
6yp8.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6yp8_validation.pdf.gz
6yp8_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6yp8_full_validation.pdf.gz
6yp8_full_validation.pdf.gz 6yp8_validation.xml.gz
6yp8_validation.xml.gz 6yp8_validation.cif.gz
6yp8_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/yp/6yp8
https://data.pdbj.org/pub/pdb/validation_reports/yp/6yp8 ftp://data.pdbj.org/pub/pdb/validation_reports/yp/6yp8
ftp://data.pdbj.org/pub/pdb/validation_reports/yp/6yp8 リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト) / 遺伝子: SFN, HME1 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: SFN, HME1 / 発現宿主: 
 Homo sapiens (ヒト) / 参照: UniProt: Q04206*PLUS
Homo sapiens (ヒト) / 参照: UniProt: Q04206*PLUS X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 分子置換
分子置換 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー





























 PDBj
PDBj