+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6vvq | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human START domain of Acyl-coenzyme A thioesterase 11 (ACOT11) bound to Myristic Acid | |||||||||
 要素 要素 | Acyl-coenzyme A thioesterase 11 | |||||||||
 キーワード キーワード | LIPID BINDING PROTEIN / START / Lipid / Thioesterase / Allostery | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報palmitoyl-CoA hydrolase / long-chain fatty acyl-CoA hydrolase activity / fatty acyl-CoA hydrolase activity / acyl-CoA metabolic process / Mitochondrial Fatty Acid Beta-Oxidation / 加水分解酵素; エステル加水分解酵素; 3価のアルコールのエステル加水分解酵素 / carboxylic ester hydrolase activity / negative regulation of cold-induced thermogenesis / response to temperature stimulus / response to cold ...palmitoyl-CoA hydrolase / long-chain fatty acyl-CoA hydrolase activity / fatty acyl-CoA hydrolase activity / acyl-CoA metabolic process / Mitochondrial Fatty Acid Beta-Oxidation / 加水分解酵素; エステル加水分解酵素; 3価のアルコールのエステル加水分解酵素 / carboxylic ester hydrolase activity / negative regulation of cold-induced thermogenesis / response to temperature stimulus / response to cold / fatty acid metabolic process / intracellular signal transduction / mitochondrial matrix / lipid binding / extracellular exosome / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.09 Å 分子置換 / 解像度: 3.09 Å | |||||||||
 データ登録者 データ登録者 | Tillman, M.C. / Ortlund, E.A. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2020 ジャーナル: Proc Natl Acad Sci U S A / 年: 2020タイトル: Allosteric regulation of thioesterase superfamily member 1 by lipid sensor domain binding fatty acids and lysophosphatidylcholine. 著者: Matthew C Tillman / Norihiro Imai / Yue Li / Manoj Khadka / C Denise Okafor / Puneet Juneja / Akshitha Adhiyaman / Susan J Hagen / David E Cohen / Eric A Ortlund /  要旨: Nonshivering thermogenesis occurs in brown adipose tissue to generate heat in response to cold ambient temperatures. Thioesterase superfamily member 1 (Them1) is transcriptionally up-regulated in ...Nonshivering thermogenesis occurs in brown adipose tissue to generate heat in response to cold ambient temperatures. Thioesterase superfamily member 1 (Them1) is transcriptionally up-regulated in brown adipose tissue upon exposure to the cold and suppresses thermogenesis in order to conserve energy reserves. It hydrolyzes long-chain fatty acyl-CoAs that are derived from lipid droplets, preventing their use as fuel for thermogenesis. In addition to its enzymatic domains, Them1 contains a C-terminal StAR-related lipid transfer (START) domain with unknown ligand or function. By complementary biophysical approaches, we show that the START domain binds to long-chain fatty acids, products of Them1's enzymatic reaction, as well as lysophosphatidylcholine (LPC), lipids shown to activate thermogenesis in brown adipocytes. Certain fatty acids stabilize the START domain and allosterically enhance Them1 catalysis of acyl-CoA, whereas 18:1 LPC destabilizes and inhibits activity, which we verify in cell culture. Additionally, we demonstrate that the START domain functions to localize Them1 near lipid droplets. These findings define the role of the START domain as a lipid sensor that allosterically regulates Them1 activity and spatially localizes it in proximity to the lipid droplet. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6vvq.cif.gz 6vvq.cif.gz | 436 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6vvq.ent.gz pdb6vvq.ent.gz | 293.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6vvq.json.gz 6vvq.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6vvq_validation.pdf.gz 6vvq_validation.pdf.gz | 291.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6vvq_full_validation.pdf.gz 6vvq_full_validation.pdf.gz | 291.3 KB | 表示 | |
| XML形式データ |  6vvq_validation.xml.gz 6vvq_validation.xml.gz | 1.3 KB | 表示 | |
| CIF形式データ |  6vvq_validation.cif.gz 6vvq_validation.cif.gz | 9.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vv/6vvq https://data.pdbj.org/pub/pdb/validation_reports/vv/6vvq ftp://data.pdbj.org/pub/pdb/validation_reports/vv/6vvq ftp://data.pdbj.org/pub/pdb/validation_reports/vv/6vvq | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||
| 2 | 
| ||||||||||||
| 3 | 
| ||||||||||||
| 4 | 
| ||||||||||||
| 単位格子 |
|
- 要素
要素
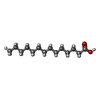
| #1: タンパク質 | 分子量: 29668.473 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ACOT11, BFIT, KIAA0707, THEA / Variant: Isoform 2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ACOT11, BFIT, KIAA0707, THEA / Variant: Isoform 2 / 発現宿主:  参照: UniProt: Q8WXI4, 加水分解酵素; エステル加水分解酵素; 3価のアルコールのエステル加水分解酵素, palmitoyl-CoA hydrolase #2: 化合物 | ChemComp-MYR / | #3: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.46 Å3/Da / 溶媒含有率: 50.04 % |
|---|---|
| 結晶化 | 温度: 277.15 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 9.4 / 詳細: 0.1 M Tris HCl pH 9.4 and 27 % PEG 8000 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 22-ID / 波長: 1 Å / ビームライン: 22-ID / 波長: 1 Å |
| 検出器 | タイプ: DECTRIS EIGER X 16M / 検出器: PIXEL / 日付: 2017年8月16日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 3.1→50 Å / Num. obs: 21217 / % possible obs: 99.3 % / 冗長度: 5.8 % / Biso Wilson estimate: 73.76 Å2 / Rpim(I) all: 0.121 / Rrim(I) all: 0.304 / Net I/σ(I): 11.3 |
| 反射 シェル | 解像度: 3.1→3.21 Å / Num. unique obs: 2083 / CC1/2: 0.647 / Rpim(I) all: 0.71 / % possible all: 99.7 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3fo5 解像度: 3.09→42.99 Å / SU ML: 0.3992 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 30.3471 / 立体化学のターゲット値: CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 80.72 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 3.09→42.99 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj