[English] 日本語
 Yorodumi
Yorodumi- PDB-6uwl: GltPh in complex with L-aspartate and sodium ions in intermediate... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6uwl | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | GltPh in complex with L-aspartate and sodium ions in intermediate outward-facing state | |||||||||
 Components Components | Glutamate transporter homolog | |||||||||
 Keywords Keywords | TRANSPORT PROTEIN / aspartate transporter | |||||||||
| Function / homology |  Function and homology information Function and homology informationL-aspartate transmembrane transport / L-aspartate transmembrane transporter activity / amino acid:sodium symporter activity / L-aspartate import across plasma membrane / chloride transmembrane transporter activity / protein homotrimerization / chloride transmembrane transport / metal ion binding / identical protein binding / plasma membrane Similarity search - Function | |||||||||
| Biological species |   Pyrococcus horikoshii (archaea) Pyrococcus horikoshii (archaea) | |||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.62 Å | |||||||||
 Authors Authors | Wang, X. / Boudker, O. | |||||||||
| Funding support |  United States, 2items United States, 2items
| |||||||||
 Citation Citation |  Journal: Nat Chem Biol / Year: 2020 Journal: Nat Chem Biol / Year: 2020Title: Use of paramagnetic F NMR to monitor domain movement in a glutamate transporter homolog. Authors: Yun Huang / Xiaoyu Wang / Guohua Lv / Asghar M Razavi / Gerard H M Huysmans / Harel Weinstein / Clay Bracken / David Eliezer / Olga Boudker /   Abstract: In proteins where conformational changes are functionally important, the number of accessible states and their dynamics are often difficult to establish. Here we describe a novel F-NMR spectroscopy ...In proteins where conformational changes are functionally important, the number of accessible states and their dynamics are often difficult to establish. Here we describe a novel F-NMR spectroscopy approach to probe dynamics of large membrane proteins. We labeled a glutamate transporter homolog with a F probe via cysteine chemistry and with a Ni ion via chelation by a di-histidine motif. We used distance-dependent enhancement of the longitudinal relaxation of F nuclei by the paramagnetic metal to assign the observed resonances. We identified one inward- and two outward-facing states of the transporter, in which the substrate-binding site is near the extracellular and intracellular solutions, respectively. We then resolved the structure of the unanticipated second outward-facing state by cryo-EM. Finally, we showed that the rates of the conformational exchange are accessible from measurements of the metal-enhanced longitudinal relaxation of F nuclei. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6uwl.cif.gz 6uwl.cif.gz | 95.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6uwl.ent.gz pdb6uwl.ent.gz | 69.2 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6uwl.json.gz 6uwl.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/uw/6uwl https://data.pdbj.org/pub/pdb/validation_reports/uw/6uwl ftp://data.pdbj.org/pub/pdb/validation_reports/uw/6uwl ftp://data.pdbj.org/pub/pdb/validation_reports/uw/6uwl | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  20923MC  6uwfC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
| #1: Protein | Mass: 44669.957 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   Pyrococcus horikoshii (archaea) / Production host: Pyrococcus horikoshii (archaea) / Production host:  |
|---|---|
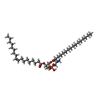
| #2: Chemical | ChemComp-ASP / |
| #3: Chemical | ChemComp-6OU / [( |
| Has ligand of interest | N |
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Complex of GltPh with L-aspartate and sodium ions in MSP1E3 nanodisc Type: COMPLEX / Entity ID: #1 / Source: RECOMBINANT |
|---|---|
| Molecular weight | Value: 0.134 MDa / Experimental value: NO |
| Source (natural) | Organism:   Pyrococcus horikoshii (archaea) Pyrococcus horikoshii (archaea) |
| Source (recombinant) | Organism:  |
| Buffer solution | pH: 7.4 |
| Specimen | Embedding applied: YES / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| EM embedding | Material: ice |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Microscopy | Model: FEI TITAN KRIOS | ||||||||||||
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM | ||||||||||||
| Electron lens | Mode: BRIGHT FIELD | ||||||||||||
| Image recording |
|
- Processing
Processing
| Software | Name: PHENIX / Version: (1.14_3260: phenix.real_space_refine) / Classification: refinement |
|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION |
| 3D reconstruction | Resolution: 3.62 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 120280 / Symmetry type: POINT |
 Movie
Movie Controller
Controller













 PDBj
PDBj