+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ql6 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of Fatty acid synthase complex from Saccharomyces cerevisiae at 2.9 Angstrom | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / Fatty acid synthase / Acyl carrier protein / Ketosynthase / Ketoreductase / Enoyl reductase / Dehydratase / Malonyl/palmitoyl transferase / Acetyl transferase / Phosphopantetheine transferase | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fatty-acyl-CoA synthase system / fatty acid synthase complex / fatty-acyl-CoA synthase activity / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity / holo-[acyl-carrier-protein] synthase activity / enoyl-[acyl-carrier-protein] reductase (NADPH) activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity ...fatty-acyl-CoA synthase system / fatty acid synthase complex / fatty-acyl-CoA synthase activity / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity / holo-[acyl-carrier-protein] synthase activity / enoyl-[acyl-carrier-protein] reductase (NADPH) activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity / 3-hydroxyacyl-[acyl-carrier-protein] dehydratase / beta-ketoacyl-[acyl-carrier-protein] synthase I / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / 3-oxoacyl-[acyl-carrier-protein] reductase / 3-oxoacyl-[acyl-carrier-protein] reductase (NADPH) activity / oleoyl-[acyl-carrier-protein] hydrolase / fatty acyl-[ACP] hydrolase activity / enoyl-[acyl-carrier-protein] reductase (NADH) / enoyl-[acyl-carrier-protein] reductase (NADH) activity / long-chain fatty acid biosynthetic process / fatty acid synthase activity / 3-oxoacyl-[acyl-carrier-protein] synthase activity / lipid droplet / magnesium ion binding / mitochondrion / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | ||||||
 データ登録者 データ登録者 | Singh, K. / Graf, B. / Linden, A. / Sautner, V. / Urlaub, H. / Tittmann, K. / Stark, H. / Chari, A. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Cell / 年: 2020 ジャーナル: Cell / 年: 2020タイトル: Discovery of a Regulatory Subunit of the Yeast Fatty Acid Synthase. 著者: Kashish Singh / Benjamin Graf / Andreas Linden / Viktor Sautner / Henning Urlaub / Kai Tittmann / Holger Stark / Ashwin Chari /  要旨: Fatty acid synthases (FASs) are central to metabolism but are also of biotechnological interest for the production of fine chemicals and biofuels from renewable resources. During fatty acid ...Fatty acid synthases (FASs) are central to metabolism but are also of biotechnological interest for the production of fine chemicals and biofuels from renewable resources. During fatty acid synthesis, the growing fatty acid chain is thought to be shuttled by the dynamic acyl carrier protein domain to several enzyme active sites. Here, we report the discovery of a γ subunit of the 2.6 megadalton α-βS. cerevisiae FAS, which is shown by high-resolution structures to stabilize a rotated FAS conformation and rearrange ACP domains from equatorial to axial positions. The γ subunit spans the length of the FAS inner cavity, impeding reductase activities of FAS, regulating NADPH turnover by kinetic hysteresis at the ketoreductase, and suppressing off-pathway reactions at the enoylreductase. The γ subunit delineates the functional compartment within FAS. As a scaffold, it may be exploited to incorporate natural and designed enzymatic activities that are not present in natural FAS. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ql6.cif.gz 6ql6.cif.gz | 4.1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ql6.ent.gz pdb6ql6.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  6ql6.json.gz 6ql6.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6ql6_validation.pdf.gz 6ql6_validation.pdf.gz | 1.9 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6ql6_full_validation.pdf.gz 6ql6_full_validation.pdf.gz | 2.1 MB | 表示 | |
| XML形式データ |  6ql6_validation.xml.gz 6ql6_validation.xml.gz | 502.1 KB | 表示 | |
| CIF形式データ |  6ql6_validation.cif.gz 6ql6_validation.cif.gz | 809.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ql/6ql6 https://data.pdbj.org/pub/pdb/validation_reports/ql/6ql6 ftp://data.pdbj.org/pub/pdb/validation_reports/ql/6ql6 ftp://data.pdbj.org/pub/pdb/validation_reports/ql/6ql6 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  4578MC  4577C  6ql5C  6ql7C  6ql9C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10470 (タイトル: Saccharomyces cerevisiae fatty acid synthase complex EMPIAR-10470 (タイトル: Saccharomyces cerevisiae fatty acid synthase complexData size: 391.7 Data #1: Aligned and doseweighted micrographs of yeast fatty acid synthase [micrographs - single frame] Data #2: final_particle_stack [picked particles - single frame - unprocessed]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
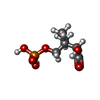
| #1: タンパク質 | 分子量: 207184.422 Da / 分子数: 6 / 由来タイプ: 天然 / 由来: (天然)  参照: UniProt: P19097, fatty-acyl-CoA synthase system, 3-oxoacyl-[acyl-carrier-protein] reductase, beta-ketoacyl-[acyl-carrier-protein] synthase I #2: タンパク質 | 分子量: 227785.141 Da / 分子数: 6 / 由来タイプ: 天然 / 由来: (天然)  参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, ...参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, [acyl-carrier-protein] S-malonyltransferase, oleoyl-[acyl-carrier-protein] hydrolase #3: 化合物 | ChemComp-J8T / [( #4: 化合物 | ChemComp-FMN / Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Fatty acid synthase at 2.9 Angstrom resolution / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: NATURAL | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 2.6 MDa / 実験値: YES | ||||||||||||||||||||
| 由来(天然) | 生物種:  株: BJ2168 (MATa prc1-407 prb1-1122 pep4-3 leu2 trp1 ura3-52 gal2 tma17::kanMX) | ||||||||||||||||||||
| 緩衝液 | pH: 6.5 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 0.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R3.5/1 | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 278 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 132000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 62 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 実像数: 5441 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1189206 | ||||||||||||||||||||||||
| 対称性 | 点対称性: D3 (2回x3回 2面回転対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 144526 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj