[English] 日本語
 Yorodumi
Yorodumi- PDB-6ngw: Structure of rat neuronal nitric oxide synthase heme domain in co... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6ngw | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of rat neuronal nitric oxide synthase heme domain in complex with 6-(5-(3-(dimethylamino)propyl)-2,3,4-trifluorophenethyl)-4-methylpyridin-2-amine | ||||||
 Components Components | Nitric oxide synthase, brain | ||||||
 Keywords Keywords | oxidoreductase/oxidoreductase inhibitor / nitric oxide synthase inhibitor complex heme enzyme / OXIDOREDUCTASE / oxidoreductase-oxidoreductase inhibitor complex | ||||||
| Function / homology |  Function and homology information Function and homology informationNitric oxide stimulates guanylate cyclase / negative regulation of hepatic stellate cell contraction / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide ...Nitric oxide stimulates guanylate cyclase / negative regulation of hepatic stellate cell contraction / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide / negative regulation of vasoconstriction / response to nitric oxide / positive regulation of adenylate cyclase-activating G protein-coupled receptor signaling pathway / response to vitamin E / negative regulation of cytosolic calcium ion concentration / positive regulation of sodium ion transmembrane transport / peptidyl-cysteine S-nitrosylase activity / positive regulation of the force of heart contraction / neuron projection terminus / cadmium ion binding / negative regulation of calcium ion transport / negative regulation of potassium ion transport / regulation of postsynaptic membrane potential / nitric oxide mediated signal transduction / nitric-oxide synthase (NADPH) / sodium channel regulator activity / regulation of neurogenesis / negative regulation of serotonin uptake / nitric-oxide synthase activity / xenobiotic catabolic process / L-arginine catabolic process / multicellular organismal response to stress / NADPH binding / striated muscle contraction / postsynaptic density, intracellular component / nitric oxide-cGMP-mediated signaling / negative regulation of blood pressure / regulation of sodium ion transport / response to hormone / nitric oxide metabolic process / behavioral response to cocaine / nitric oxide biosynthetic process / photoreceptor inner segment / cellular response to epinephrine stimulus / T-tubule / sarcoplasmic reticulum membrane / secretory granule / calyx of Held / positive regulation of long-term synaptic potentiation / response to activity / cell periphery / sarcoplasmic reticulum / response to nicotine / establishment of localization in cell / phosphoprotein binding / establishment of protein localization / female pregnancy / cellular response to mechanical stimulus / response to nutrient levels / negative regulation of insulin secretion / sarcolemma / caveola / response to peptide hormone / response to lead ion / response to estrogen / cellular response to growth factor stimulus / vasodilation / Z disc / calcium-dependent protein binding / FMN binding / NADP binding / flavin adenine dinucleotide binding / positive regulation of neuron apoptotic process / response to heat / ATPase binding / scaffold protein binding / response to lipopolysaccharide / nuclear membrane / dendritic spine / response to ethanol / negative regulation of neuron apoptotic process / perikaryon / RNA polymerase II-specific DNA-binding transcription factor binding / transmembrane transporter binding / cytoskeleton / response to hypoxia / mitochondrial outer membrane / calmodulin binding / postsynaptic density / membrane raft / negative regulation of cell population proliferation / heme binding / synapse / dendrite / negative regulation of apoptotic process / positive regulation of DNA-templated transcription / perinuclear region of cytoplasm / glutamatergic synapse / enzyme binding / positive regulation of transcription by RNA polymerase II Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  FOURIER SYNTHESIS / Resolution: 1.858 Å FOURIER SYNTHESIS / Resolution: 1.858 Å | ||||||
 Authors Authors | Li, H. / Poulos, T.L. | ||||||
| Funding support |  United States, 1items United States, 1items
| ||||||
 Citation Citation |  Journal: J. Med. Chem. / Year: 2019 Journal: J. Med. Chem. / Year: 2019Title: Optimization of Blood-Brain Barrier Permeability with Potent and Selective Human Neuronal Nitric Oxide Synthase Inhibitors Having a 2-Aminopyridine Scaffold. Authors: Do, H.T. / Li, H. / Chreifi, G. / Poulos, T.L. / Silverman, R.B. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6ngw.cif.gz 6ngw.cif.gz | 367.3 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6ngw.ent.gz pdb6ngw.ent.gz | 296.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6ngw.json.gz 6ngw.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ng/6ngw https://data.pdbj.org/pub/pdb/validation_reports/ng/6ngw ftp://data.pdbj.org/pub/pdb/validation_reports/ng/6ngw ftp://data.pdbj.org/pub/pdb/validation_reports/ng/6ngw | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  6ng1C  6ng2C  6ng4C  6ng5C  6ng6C  6ng7C  6ng8C  6ngaC  6ngbC  6ngcC  6ngdC  6ngeC  6ngfC  6nghC  6ngiC  6ngjC  6ngkC  6nglC  6ngmC  6ngnC  6ngpC  6ngqC  6ngrC  6ngsC  6ngtC  6nguC  6ngvC  6ngxC  6ngyC  6ngzC  6nh0C  6nh1C  6nh2C  6nh3C  6nh4C  6nh5C  6nh6C  6nh7C  6nh8C  6nhbC  6nhcC  6nhdC  6nheC  6nhfC  1om4S S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 1 types, 2 molecules AB
| #1: Protein | Mass: 48812.527 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|
-Non-polymers , 7 types, 501 molecules 

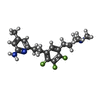










| #2: Chemical | | #3: Chemical | #4: Chemical | #5: Chemical | #6: Chemical | ChemComp-ZN / | #7: Chemical | #8: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.48 Å3/Da / Density % sol: 50.4 % / Description: bricks |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 5.8 Details: 20-24% PEG3350, 0.1M MES 0.14-0.20M AMMONIUM ACETATE, 10% ETHYLENE GLYCOL, 30uM SDS, 5 mM GSH |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRL SSRL  / Beamline: BL12-2 / Wavelength: 0.979 Å / Beamline: BL12-2 / Wavelength: 0.979 Å |
| Detector | Type: DECTRIS PILATUS 300K / Detector: PIXEL / Date: Mar 29, 2018 |
| Radiation | Monochromator: graphite / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.979 Å / Relative weight: 1 |
| Reflection | Resolution: 1.858→60 Å / Num. obs: 81145 / % possible obs: 99.8 % / Observed criterion σ(I): -3 / Redundancy: 11.8 % / CC1/2: 0.999 / Rmerge(I) obs: 0.123 / Rpim(I) all: 0.036 / Rsym value: 0.123 / Net I/σ(I): 11.3 |
| Reflection shell | Resolution: 1.86→1.91 Å / Redundancy: 5.9 % / Rmerge(I) obs: 2.029 / Mean I/σ(I) obs: 0.8 / Num. unique obs: 4184 / CC1/2: 0.66 / Rpim(I) all: 0.891 / Rsym value: 2.029 / % possible all: 96.4 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  FOURIER SYNTHESIS FOURIER SYNTHESISStarting model: 1OM4 Resolution: 1.858→55.617 Å / SU ML: 0.2 / Cross valid method: FREE R-VALUE / σ(F): 0.01 / Phase error: 27.09
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.858→55.617 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller






















 PDBj
PDBj









