| 登録情報 | データベース: PDB / ID: 6f27
|
|---|
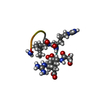
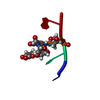
| タイトル | NMR solution structure of non-bound [des-Arg10]-kallidin (DAKD) |
|---|
 要素 要素 | DAKD |
|---|
 キーワード キーワード | MEMBRANE PROTEIN / GPCR G-protein-coupled receptor peptide bradykinin kallidin human kinin |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of cell adhesion / cysteine-type endopeptidase inhibitor activity / negative regulation of blood coagulation / Intrinsic Pathway of Fibrin Clot Formation / negative regulation of proteolysis / Peptide ligand-binding receptors / platelet alpha granule lumen / Post-translational protein phosphorylation / hormone activity / vasodilation ...negative regulation of cell adhesion / cysteine-type endopeptidase inhibitor activity / negative regulation of blood coagulation / Intrinsic Pathway of Fibrin Clot Formation / negative regulation of proteolysis / Peptide ligand-binding receptors / platelet alpha granule lumen / Post-translational protein phosphorylation / hormone activity / vasodilation / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / blood coagulation / Platelet degranulation / heparin binding / : / positive regulation of cytosolic calcium ion concentration / blood microparticle / G alpha (i) signalling events / G alpha (q) signalling events / positive regulation of apoptotic process / inflammatory response / endoplasmic reticulum lumen / signaling receptor binding / extracellular space / extracellular exosome / extracellular region / zinc ion binding / plasma membrane類似検索 - 分子機能 HMW kininogen / Kininogen-type cystatin domain / Kininogen-type cystatin domain profile. / : / Proteinase inhibitor I25, cystatin, conserved site / Cysteine proteases inhibitors signature. / Cystatin domain / Cystatin-like domain / Cystatin domain / Cystatin superfamily類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 溶液NMR / torsion angle dynamics / simulated annealing |
|---|
 データ登録者 データ登録者 | Richter, C. / Jonker, H.R.A. / Schwalbe, H. / Joedicke, L. / Mao, J. / Kuenze, G. / Reinhart, C. / Kalavacherla, T. / Meiler, J. / Preu, J. ...Richter, C. / Jonker, H.R.A. / Schwalbe, H. / Joedicke, L. / Mao, J. / Kuenze, G. / Reinhart, C. / Kalavacherla, T. / Meiler, J. / Preu, J. / Michel, H. / Glaubitz, C. |
|---|
| 資金援助 |  ドイツ, ドイツ,  米国, 3件 米国, 3件 | 組織 | 認可番号 | 国 |
|---|
| German Research Foundation | G-NMR, SFB 807, GL 307/8-1, Macromolecular Complexes |  ドイツ ドイツ | | State of Hesse | BMRZ |  ドイツ ドイツ | | NIH and NSF | R01 GM080403, R01 GM099842, R01 GM073151, CHE 1305874 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Nat. Chem. Biol. / 年: 2018 ジャーナル: Nat. Chem. Biol. / 年: 2018
タイトル: The molecular basis of subtype selectivity of human kinin G-protein-coupled receptors.
著者: Joedicke, L. / Mao, J. / Kuenze, G. / Reinhart, C. / Kalavacherla, T. / Jonker, H.R.A. / Richter, C. / Schwalbe, H. / Meiler, J. / Preu, J. / Michel, H. / Glaubitz, C. |
|---|
| 履歴 | | 登録 | 2017年11月23日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2018年1月10日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年1月17日 | Group: Database references / カテゴリ: citation
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.year |
|---|
| 改定 1.2 | 2018年1月24日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_abbrev / _citation.pdbx_database_id_PubMed / _citation.title |
|---|
| 改定 1.3 | 2018年1月31日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.4 | 2018年2月21日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.5 | 2019年5月8日 | Group: Data collection / カテゴリ: pdbx_nmr_software / Item: _pdbx_nmr_software.name |
|---|
| 改定 1.6 | 2023年6月14日 | Group: Data collection / Database references / Other
カテゴリ: database_2 / pdbx_database_status / pdbx_nmr_spectrometer
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_nmr_data / _pdbx_nmr_spectrometer.model |
|---|
| 改定 1.7 | 2024年6月19日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2 / Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 ドイツ,
ドイツ,  米国, 3件
米国, 3件  引用
引用 ジャーナル: Nat. Chem. Biol. / 年: 2018
ジャーナル: Nat. Chem. Biol. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6f27.cif.gz
6f27.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6f27.ent.gz
pdb6f27.ent.gz PDB形式
PDB形式 6f27.json.gz
6f27.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6f27_validation.pdf.gz
6f27_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6f27_full_validation.pdf.gz
6f27_full_validation.pdf.gz 6f27_validation.xml.gz
6f27_validation.xml.gz 6f27_validation.cif.gz
6f27_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/f2/6f27
https://data.pdbj.org/pub/pdb/validation_reports/f2/6f27 ftp://data.pdbj.org/pub/pdb/validation_reports/f2/6f27
ftp://data.pdbj.org/pub/pdb/validation_reports/f2/6f27


 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: P01042
Homo sapiens (ヒト) / 参照: UniProt: P01042 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj






 HSQC
HSQC