+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6e1f | ||||||
|---|---|---|---|---|---|---|---|
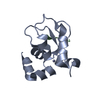
| タイトル | Crystal structure of the SWIRM domain of human histone lysine-specific demethylase LSD1 | ||||||
 要素 要素 | Lysine-specific histone demethylase 1A | ||||||
 キーワード キーワード | OXIDOREDUCTASE / Histone lysine specific demethylase / SWIRM domain | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報guanine metabolic process / negative regulation of transcription initiation-coupled chromatin remodeling / protein demethylase activity / [histone H3]-N6,N6-dimethyl-L-lysine4 FAD-dependent demethylase / FAD-dependent H3K4me/H3K4me3 demethylase activity / telomeric repeat-containing RNA binding / histone H3K4 demethylase activity / neuron maturation / muscle cell development / positive regulation of neural precursor cell proliferation ...guanine metabolic process / negative regulation of transcription initiation-coupled chromatin remodeling / protein demethylase activity / [histone H3]-N6,N6-dimethyl-L-lysine4 FAD-dependent demethylase / FAD-dependent H3K4me/H3K4me3 demethylase activity / telomeric repeat-containing RNA binding / histone H3K4 demethylase activity / neuron maturation / muscle cell development / positive regulation of neural precursor cell proliferation / negative regulation of intrinsic apoptotic signaling pathway by p53 class mediator / MRF binding / regulation of androgen receptor signaling pathway / DNA repair complex / nuclear androgen receptor binding / regulation of double-strand break repair via homologous recombination / negative regulation of intrinsic apoptotic signaling pathway in response to DNA damage by p53 class mediator / positive regulation of neuroblast proliferation / DNA repair-dependent chromatin remodeling / positive regulation of stem cell proliferation / histone H3K9 demethylase activity / negative regulation of DNA damage response, signal transduction by p53 class mediator / histone methyltransferase complex / histone demethylase activity / positive regulation of cell size / positive regulation of epithelial to mesenchymal transition / response to fungicide / NR1H3 & NR1H2 regulate gene expression linked to cholesterol transport and efflux / cellular response to cAMP / epigenetic regulation of gene expression / positive regulation of protein ubiquitination / Regulation of PTEN gene transcription / HDACs deacetylate histones / promoter-specific chromatin binding / cellular response to gamma radiation / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / positive regulation of neuron projection development / HDMs demethylate histones / cerebral cortex development / protein modification process / cellular response to UV / p53 binding / transcription corepressor activity / flavin adenine dinucleotide binding / regulation of protein localization / positive regulation of cold-induced thermogenesis / Factors involved in megakaryocyte development and platelet production / transcription regulator complex / DNA-binding transcription factor binding / Estrogen-dependent gene expression / Potential therapeutics for SARS / RNA polymerase II-specific DNA-binding transcription factor binding / transcription coactivator activity / chromosome, telomeric region / oxidoreductase activity / chromatin binding / regulation of transcription by RNA polymerase II / chromatin / enzyme binding / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / protein-containing complex / nucleoplasm / identical protein binding / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.16 Å 分子置換 / 解像度: 1.16 Å | ||||||
 データ登録者 データ登録者 | Luka, Z. / Pakhomova, S. / Reiter, N.J. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Transient and highly ordered structural domains exist within the N-terminus of LSD1 and differentially interact with mononucleosomes 著者: Zeng, D. / Brown, B.P. / Luka, Z. / Pakhomova, S. / Martin, B. / Moore, K. / Meiler, J. / Reiter, N.J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6e1f.cif.gz 6e1f.cif.gz | 298.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6e1f.ent.gz pdb6e1f.ent.gz | 246.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6e1f.json.gz 6e1f.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6e1f_validation.pdf.gz 6e1f_validation.pdf.gz | 470.2 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6e1f_full_validation.pdf.gz 6e1f_full_validation.pdf.gz | 477 KB | 表示 | |
| XML形式データ |  6e1f_validation.xml.gz 6e1f_validation.xml.gz | 20.5 KB | 表示 | |
| CIF形式データ |  6e1f_validation.cif.gz 6e1f_validation.cif.gz | 30 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e1/6e1f https://data.pdbj.org/pub/pdb/validation_reports/e1/6e1f ftp://data.pdbj.org/pub/pdb/validation_reports/e1/6e1f ftp://data.pdbj.org/pub/pdb/validation_reports/e1/6e1f | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5it3S S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Component-ID: _ / Beg auth comp-ID: GLY / Beg label comp-ID: GLY / End auth comp-ID: TYR / End label comp-ID: TYR / Refine code: _ / Auth seq-ID: 179 - 267 / Label seq-ID: 1 - 89
NCSアンサンブル:
|
- 要素
要素
| #1: タンパク質 | 分子量: 10233.597 Da / 分子数: 4 / 断片: SWIRM domain (UNP residues 183-267) / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: KDM1A, AOF2, KDM1, KIAA0601, LSD1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: KDM1A, AOF2, KDM1, KIAA0601, LSD1 / 発現宿主:  #2: 化合物 | #3: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.7 Å3/Da / 溶媒含有率: 27.75 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 6.5 詳細: 0.1 M Bis-Tris, pH 6.5, 0.1 M potassium chloride, 1.5 M ammonium sulfate |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 21-ID-G / 波長: 0.97857 Å / ビームライン: 21-ID-G / 波長: 0.97857 Å |
| 検出器 | タイプ: MARMOSAIC 300 mm CCD / 検出器: CCD / 日付: 2018年3月1日 |
| 放射 | モノクロメーター: diamond(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97857 Å / 相対比: 1 |
| 反射 | 解像度: 1.16→35.18 Å / Num. obs: 94426 / % possible obs: 96.8 % / 冗長度: 11.4 % / Rsym value: 0.072 / Net I/σ(I): 50.7 |
| 反射 シェル | 解像度: 1.16→1.19 Å / 冗長度: 8.7 % / Mean I/σ(I) obs: 3.5 / Rsym value: 0.507 / % possible all: 86.4 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 5IT3 解像度: 1.16→35.18 Å / Cor.coef. Fo:Fc: 0.98 / Cor.coef. Fo:Fc free: 0.97 / SU B: 1.15 / SU ML: 0.024 / 交差検証法: THROUGHOUT / ESU R: 0.037 / ESU R Free: 0.038 / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 14.21 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.16→35.18 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






