| 登録情報 | データベース: PDB / ID: 6dun
|
|---|
| タイトル | Crystal Structure Analysis of PIN1 |
|---|
 要素 要素 | Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1 |
|---|
 キーワード キーワード | ISOMERASE / prolyl isomerase |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
cis-trans isomerase activity / phosphothreonine residue binding / negative regulation of cell motility / ubiquitin ligase activator activity / regulation of protein localization to nucleus / GTPase activating protein binding / mitogen-activated protein kinase kinase binding / protein targeting to mitochondrion / protein peptidyl-prolyl isomerization / regulation of mitotic nuclear division ...cis-trans isomerase activity / phosphothreonine residue binding / negative regulation of cell motility / ubiquitin ligase activator activity / regulation of protein localization to nucleus / GTPase activating protein binding / mitogen-activated protein kinase kinase binding / protein targeting to mitochondrion / protein peptidyl-prolyl isomerization / regulation of mitotic nuclear division / negative regulation of SMAD protein signal transduction / PI5P Regulates TP53 Acetylation / negative regulation of amyloid-beta formation / cytoskeletal motor activity / RHO GTPases Activate NADPH Oxidases / phosphoserine residue binding / postsynaptic cytosol / negative regulation of protein binding / Rho protein signal transduction / regulation of cytokinesis / Negative regulators of DDX58/IFIH1 signaling / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / phosphoprotein binding / negative regulation of transforming growth factor beta receptor signaling pathway / synapse organization / beta-catenin binding / negative regulation of protein catabolic process / regulation of protein stability / negative regulation of ERK1 and ERK2 cascade / ISG15 antiviral mechanism / tau protein binding / positive regulation of protein phosphorylation / neuron differentiation / positive regulation of canonical Wnt signaling pathway / regulation of gene expression / midbody / cellular response to hypoxia / Regulation of TP53 Activity through Phosphorylation / response to hypoxia / protein stabilization / nuclear speck / ciliary basal body / glutamatergic synapse / positive regulation of transcription by RNA polymerase II / nucleoplasm / nucleus / cytoplasm / cytosol類似検索 - 分子機能 : / Peptidyl-prolyl cis-trans isomerase, PpiC-type, conserved site / PpiC-type peptidyl-prolyl cis-trans isomerase signature. / PPIC-type PPIASE domain / PpiC-type peptidyl-prolyl cis-trans isomerase family profile. / Peptidyl-prolyl cis-trans isomerase, PpiC-type / Chitinase A; domain 3 - #40 / Chitinase A; domain 3 / WW domain / WW/rsp5/WWP domain signature. ...: / Peptidyl-prolyl cis-trans isomerase, PpiC-type, conserved site / PpiC-type peptidyl-prolyl cis-trans isomerase signature. / PPIC-type PPIASE domain / PpiC-type peptidyl-prolyl cis-trans isomerase family profile. / Peptidyl-prolyl cis-trans isomerase, PpiC-type / Chitinase A; domain 3 - #40 / Chitinase A; domain 3 / WW domain / WW/rsp5/WWP domain signature. / WW domain superfamily / WW/rsp5/WWP domain profile. / Domain with 2 conserved Trp (W) residues / WW domain / Peptidyl-prolyl cis-trans isomerase domain superfamily / Roll / Alpha Beta類似検索 - ドメイン・相同性 TRIHYDROXYARSENITE(III) / Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.59 Å 分子置換 / 解像度: 1.59 Å |
|---|
 データ登録者 データ登録者 | Seo, H.-S. / Dhe-Paganon, S. |
|---|
 引用 引用 |  ジャーナル: Nat Commun / 年: 2018 ジャーナル: Nat Commun / 年: 2018
タイトル: Arsenic targets Pin1 and cooperates with retinoic acid to inhibit cancer-driving pathways and tumor-initiating cells.
著者: Kozono, S. / Lin, Y.M. / Seo, H.S. / Pinch, B. / Lian, X. / Qiu, C. / Herbert, M.K. / Chen, C.H. / Tan, L. / Gao, Z.J. / Massefski, W. / Doctor, Z.M. / Jackson, B.P. / Chen, Y. / Dhe-Paganon, ...著者: Kozono, S. / Lin, Y.M. / Seo, H.S. / Pinch, B. / Lian, X. / Qiu, C. / Herbert, M.K. / Chen, C.H. / Tan, L. / Gao, Z.J. / Massefski, W. / Doctor, Z.M. / Jackson, B.P. / Chen, Y. / Dhe-Paganon, S. / Lu, K.P. / Zhou, X.Z. |
|---|
| 履歴 | | 登録 | 2018年6月21日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年3月6日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2019年4月17日 | Group: Author supporting evidence / Data collection / カテゴリ: pdbx_audit_support |
|---|
| 改定 1.2 | 2023年10月11日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.59 Å
分子置換 / 解像度: 1.59 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat Commun / 年: 2018
ジャーナル: Nat Commun / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6dun.cif.gz
6dun.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6dun.ent.gz
pdb6dun.ent.gz PDB形式
PDB形式 6dun.json.gz
6dun.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6dun_validation.pdf.gz
6dun_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6dun_full_validation.pdf.gz
6dun_full_validation.pdf.gz 6dun_validation.xml.gz
6dun_validation.xml.gz 6dun_validation.cif.gz
6dun_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/du/6dun
https://data.pdbj.org/pub/pdb/validation_reports/du/6dun ftp://data.pdbj.org/pub/pdb/validation_reports/du/6dun
ftp://data.pdbj.org/pub/pdb/validation_reports/du/6dun
 リンク
リンク 集合体
集合体

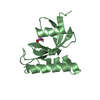
 要素
要素 Homo sapiens (ヒト) / 遺伝子: PIN1 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PIN1 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 24-ID-E / 波長: 0.9792 Å
/ ビームライン: 24-ID-E / 波長: 0.9792 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj