| 登録情報 | データベース: PDB / ID: 6cwa
|
|---|
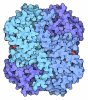
| タイトル | CRYSTAL STRUCTURE PHGDH IN COMPLEX WITH NADH AND 3-PHOSPHOGLYCERATE AT 1.77 A RESOLUTION |
|---|
 要素 要素 | D-3-phosphoglycerate dehydrogenase |
|---|
 キーワード キーワード | OXIDOREDUCTASE / PHGDH |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
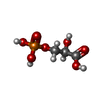
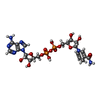
2-oxoglutarate reductase / threonine metabolic process / glial cell development / taurine metabolic process / phosphoglycerate dehydrogenase / phosphoglycerate dehydrogenase activity / gamma-aminobutyric acid metabolic process / Serine metabolism / glycine metabolic process / malate dehydrogenase ...2-oxoglutarate reductase / threonine metabolic process / glial cell development / taurine metabolic process / phosphoglycerate dehydrogenase / phosphoglycerate dehydrogenase activity / gamma-aminobutyric acid metabolic process / Serine metabolism / glycine metabolic process / malate dehydrogenase / L-serine biosynthetic process / L-malate dehydrogenase (NAD+) activity / glutamine metabolic process / G1 to G0 transition / neural tube development / spinal cord development / brain development / NAD binding / neuron projection development / regulation of gene expression / electron transfer activity / extracellular exosome / cytosol類似検索 - 分子機能 D-3-phosphoglycerate dehydrogenase / D-3-phosphoglycerate dehydrogenase, ASB domain / D-3-phosphoglycerate dehydrogenase intervening domain / Allosteric substrate binding domain superfamily / D-isomer specific 2-hydroxyacid dehydrogenases signature 2. / D-isomer specific 2-hydroxyacid dehydrogenases NAD-binding signature. / D-isomer specific 2-hydroxyacid dehydrogenases signature 3. / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site 1 / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain ...D-3-phosphoglycerate dehydrogenase / D-3-phosphoglycerate dehydrogenase, ASB domain / D-3-phosphoglycerate dehydrogenase intervening domain / Allosteric substrate binding domain superfamily / D-isomer specific 2-hydroxyacid dehydrogenases signature 2. / D-isomer specific 2-hydroxyacid dehydrogenases NAD-binding signature. / D-isomer specific 2-hydroxyacid dehydrogenases signature 3. / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site 1 / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD binding domain / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 3-PHOSPHOGLYCERIC ACID / 1,4-DIHYDRONICOTINAMIDE ADENINE DINUCLEOTIDE / D-3-phosphoglycerate dehydrogenase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.77 Å 分子置換 / 解像度: 1.77 Å |
|---|
 データ登録者 データ登録者 | Davies, D.R. / Edwards, T.E. |
|---|
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2019 ジャーナル: J.Med.Chem. / 年: 2019
タイトル: Intracellular Trapping of the Selective Phosphoglycerate Dehydrogenase (PHGDH) InhibitorBI-4924Disrupts Serine Biosynthesis.
著者: Weinstabl, H. / Treu, M. / Rinnenthal, J. / Zahn, S.K. / Ettmayer, P. / Bader, G. / Dahmann, G. / Kessler, D. / Rumpel, K. / Mischerikow, N. / Savarese, F. / Gerstberger, T. / Mayer, M. / ...著者: Weinstabl, H. / Treu, M. / Rinnenthal, J. / Zahn, S.K. / Ettmayer, P. / Bader, G. / Dahmann, G. / Kessler, D. / Rumpel, K. / Mischerikow, N. / Savarese, F. / Gerstberger, T. / Mayer, M. / Zoephel, A. / Schnitzer, R. / Sommergruber, W. / Martinelli, P. / Arnhof, H. / Peric-Simov, B. / Hofbauer, K.S. / Garavel, G. / Scherbantin, Y. / Mitzner, S. / Fett, T.N. / Scholz, G. / Bruchhaus, J. / Burkard, M. / Kousek, R. / Ciftci, T. / Sharps, B. / Schrenk, A. / Harrer, C. / Haering, D. / Wolkerstorfer, B. / Zhang, X. / Lv, X. / Du, A. / Li, D. / Li, Y. / Quant, J. / Pearson, M. / McConnell, D.B. |
|---|
| 履歴 | | 登録 | 2018年3月30日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年8月7日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2019年9月25日 | Group: Data collection / Database references / カテゴリ: citation / citation_author
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title / _citation_author.name |
|---|
| 改定 1.2 | 2023年10月4日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.77 Å
分子置換 / 解像度: 1.77 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Med.Chem. / 年: 2019
ジャーナル: J.Med.Chem. / 年: 2019 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6cwa.cif.gz
6cwa.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6cwa.ent.gz
pdb6cwa.ent.gz PDB形式
PDB形式 6cwa.json.gz
6cwa.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6cwa_validation.pdf.gz
6cwa_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6cwa_full_validation.pdf.gz
6cwa_full_validation.pdf.gz 6cwa_validation.xml.gz
6cwa_validation.xml.gz 6cwa_validation.cif.gz
6cwa_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/cw/6cwa
https://data.pdbj.org/pub/pdb/validation_reports/cw/6cwa ftp://data.pdbj.org/pub/pdb/validation_reports/cw/6cwa
ftp://data.pdbj.org/pub/pdb/validation_reports/cw/6cwa リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: PHGDH, PGDH3 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PHGDH, PGDH3 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 21-ID-F / 波長: 0.97872 Å
/ ビームライン: 21-ID-F / 波長: 0.97872 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj