| 登録情報 | データベース: PDB / ID: 6atv
|
|---|
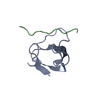
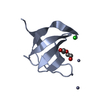
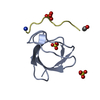
| タイトル | The molecular mechanisms by which NS1 of the 1918 Spanish influenza A virus hijack host protein-protein interactions |
|---|
 要素 要素 | - Adapter molecule crk
- proline-rich motif in IAV-NS1
|
|---|
 キーワード キーワード | protein binding/viral protein / SH3 / CrkII / Nonstructural Protein 1 / Influenza A Virus / VIRAL PROTEIN / protein binding-viral protein complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
response to hepatocyte growth factor / regulation of intracellular signal transduction / cellular response to endothelin / helper T cell diapedesis / cerebellar neuron development / response to cholecystokinin / postsynaptic specialization assembly / protein phosphorylated amino acid binding / regulation of T cell migration / symbiont-mediated suppression of host mRNA processing ...response to hepatocyte growth factor / regulation of intracellular signal transduction / cellular response to endothelin / helper T cell diapedesis / cerebellar neuron development / response to cholecystokinin / postsynaptic specialization assembly / protein phosphorylated amino acid binding / regulation of T cell migration / symbiont-mediated suppression of host mRNA processing / reelin-mediated signaling pathway / regulation of dendrite development / positive regulation of skeletal muscle acetylcholine-gated channel clustering / symbiont-mediated suppression of host PKR/eIFalpha signaling / negative regulation of natural killer cell mediated cytotoxicity / response to yeast / negative regulation of wound healing / regulation of protein binding / negative regulation of cell motility / ARMS-mediated activation / protein serine/threonine kinase inhibitor activity / protein localization to membrane / MET receptor recycling / MET activates RAP1 and RAC1 / cellular response to insulin-like growth factor stimulus / establishment of cell polarity / regulation of GTPase activity / p130Cas linkage to MAPK signaling for integrins / positive regulation of smooth muscle cell migration / dendrite development / positive regulation of Rac protein signal transduction / regulation of cell adhesion mediated by integrin / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / cellular response to nitric oxide / regulation of signal transduction / ephrin receptor signaling pathway / PTK6 Regulates RHO GTPases, RAS GTPase and MAP kinases / signaling adaptor activity / positive regulation of substrate adhesion-dependent cell spreading / cellular response to transforming growth factor beta stimulus / cytoskeletal protein binding / ephrin receptor binding / phosphotyrosine residue binding / Downstream signal transduction / SH2 domain binding / protein tyrosine kinase binding / cell chemotaxis / cellular response to nerve growth factor stimulus / Regulation of signaling by CBL / hippocampus development / regulation of actin cytoskeleton organization / positive regulation of JNK cascade / FCGR3A-mediated phagocytosis / insulin-like growth factor receptor binding / neuron migration / response to hydrogen peroxide / neuromuscular junction / lipid metabolic process / receptor tyrosine kinase binding / cerebral cortex development / Regulation of actin dynamics for phagocytic cup formation / kinase binding / VEGFA-VEGFR2 Pathway / SH3 domain binding / : / signaling receptor complex adaptor activity / cell migration / actin cytoskeleton / regulation of cell shape / actin cytoskeleton organization / scaffold protein binding / positive regulation of cell growth / cell population proliferation / host cell cytoplasm / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / virus-mediated perturbation of host defense response / ubiquitin protein ligase binding / host cell nucleus / regulation of transcription by RNA polymerase II / signal transduction / protein-containing complex / RNA binding / extracellular exosome / membrane / nucleus / plasma membrane / cytoplasm / cytosol類似検索 - 分子機能 CRK, N-terminal SH3 domain / CRK, C-terminal SH3 domain / Influenza A virus NS1 protein / Influenza A virus NS1, effector domain-like superfamily / Influenza non-structural protein (NS1) / Influenza non-structural protein (NS1) / Variant SH3 domain / SH3 Domains / SH3 domain / SH2 domain ...CRK, N-terminal SH3 domain / CRK, C-terminal SH3 domain / Influenza A virus NS1 protein / Influenza A virus NS1, effector domain-like superfamily / Influenza non-structural protein (NS1) / Influenza non-structural protein (NS1) / Variant SH3 domain / SH3 Domains / SH3 domain / SH2 domain / Src homology 2 (SH2) domain profile. / Src homology 2 domains / SH3 type barrels. / SH2 domain / Src homology 3 domains / SH2 domain superfamily / SH3-like domain superfamily / Src homology 3 (SH3) domain profile. / SH3 domain / S15/NS1, RNA-binding / Roll / Mainly Beta類似検索 - ドメイン・相同性 Adapter molecule crk / Non-structural protein 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)
 Orthomyxoviridae (ウイルス) Orthomyxoviridae (ウイルス) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.751 Å 分子置換 / 解像度: 1.751 Å |
|---|
 データ登録者 データ登録者 | Shen, Q. / Zeng, D. / Zhao, B. / Li, P. / Cho, J.H. |
|---|
 引用 引用 |  ジャーナル: Biophys. J. / 年: 2018 ジャーナル: Biophys. J. / 年: 2018
タイトル: Molecular Mechanisms of Tight Binding through Fuzzy Interactions.
著者: Shen, Q. / Shi, J. / Zeng, D. / Zhao, B. / Li, P. / Hwang, W. / Cho, J.H. |
|---|
| 履歴 | | 登録 | 2017年8月29日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2018年8月8日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2023年10月4日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) Orthomyxoviridae (ウイルス)
Orthomyxoviridae (ウイルス) X線回折 /
X線回折 /  分子置換 / 解像度: 1.751 Å
分子置換 / 解像度: 1.751 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biophys. J. / 年: 2018
ジャーナル: Biophys. J. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6atv.cif.gz
6atv.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6atv.ent.gz
pdb6atv.ent.gz PDB形式
PDB形式 6atv.json.gz
6atv.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6atv_validation.pdf.gz
6atv_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6atv_full_validation.pdf.gz
6atv_full_validation.pdf.gz 6atv_validation.xml.gz
6atv_validation.xml.gz 6atv_validation.cif.gz
6atv_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/at/6atv
https://data.pdbj.org/pub/pdb/validation_reports/at/6atv ftp://data.pdbj.org/pub/pdb/validation_reports/at/6atv
ftp://data.pdbj.org/pub/pdb/validation_reports/at/6atv
 リンク
リンク 集合体
集合体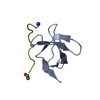
 要素
要素 Homo sapiens (ヒト) / 遺伝子: CRK / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: CRK / 発現宿主: 
 Orthomyxoviridae (ウイルス) / 参照: UniProt: Q99AU3*PLUS
Orthomyxoviridae (ウイルス) / 参照: UniProt: Q99AU3*PLUS X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU / 波長: 1.45 Å
回転陽極 / タイプ: RIGAKU / 波長: 1.45 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj











