| 登録情報 | データベース: PDB / ID: 5wlo
|
|---|
| タイトル | a novel 13-ring macrocyclic HIV-1 protease inhibitors involving the P1'-P2' ligands |
|---|
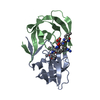
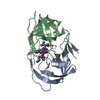
 要素 要素 | Protease |
|---|
 キーワード キーワード | hydrolase/hydrolase inhibitor / HIV protease / Macrocyclic inhibitors / P1'- P2' ligands / Drug resistance / HYDROLASE / hydrolase-hydrolase inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
exoribonuclease H activity / DNA integration / viral genome integration into host DNA / establishment of integrated proviral latency / RNA stem-loop binding / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / DNA recombination / aspartic-type endopeptidase activity / symbiont entry into host cell ...exoribonuclease H activity / DNA integration / viral genome integration into host DNA / establishment of integrated proviral latency / RNA stem-loop binding / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / DNA recombination / aspartic-type endopeptidase activity / symbiont entry into host cell / proteolysis / DNA binding / zinc ion binding類似検索 - 分子機能 Reverse transcriptase connection / Reverse transcriptase connection domain / Reverse transcriptase thumb / Reverse transcriptase thumb domain / Integrase Zinc binding domain / Zinc finger integrase-type profile. / Integrase-like, N-terminal / Integrase DNA binding domain / Integrase, C-terminal domain superfamily, retroviral / Integrase, N-terminal zinc-binding domain ...Reverse transcriptase connection / Reverse transcriptase connection domain / Reverse transcriptase thumb / Reverse transcriptase thumb domain / Integrase Zinc binding domain / Zinc finger integrase-type profile. / Integrase-like, N-terminal / Integrase DNA binding domain / Integrase, C-terminal domain superfamily, retroviral / Integrase, N-terminal zinc-binding domain / Integrase, C-terminal, retroviral / Integrase DNA binding domain profile. / RNase H / Integrase core domain / Integrase, catalytic core / Integrase catalytic domain profile. / Retropepsin-like catalytic domain / Ribonuclease H domain / RNase H type-1 domain profile. / Reverse transcriptase (RNA-dependent DNA polymerase) / Reverse transcriptase domain / Reverse transcriptase (RT) catalytic domain profile. / Retropepsins / Retroviral aspartyl protease / Aspartyl protease, retroviral-type family profile. / Peptidase A2A, retrovirus, catalytic / Cathepsin D, subunit A; domain 1 / Acid Proteases / Aspartic peptidase, active site / Eukaryotic and viral aspartyl proteases active site. / Ribonuclease H superfamily / Aspartic peptidase domain superfamily / Ribonuclease H-like superfamily / Reverse transcriptase/Diguanylate cyclase domain / DNA/RNA polymerase superfamily / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 ACETATE ION / Chem-GR7 / Protease / POL polyprotein類似検索 - 構成要素 |
|---|
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.27 Å 分子置換 / 解像度: 1.27 Å |
|---|
 データ登録者 データ登録者 | Wang, Y.-F. / Agniswamy, J. / Weber, I.T. |
|---|
| 資金援助 |  米国, 米国,  日本, 7件 日本, 7件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM53386 |  米国 米国 | | National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM62920 |  米国 米国 | | National Institutes of Health/National Cancer Institute (NIH/NCI) | |  米国 米国 | | Ministry of Education, Culture, Sports, Science and Technology (Japan) | a Grant-in-Aid for Scientific Research (Priority Areas) |  日本 日本 | | Ministry of Health,Labour and Welfare (Japan) | a Grant for Promotion of AIDS Research |  日本 日本 | | Ministry of Education, Culture, Sports, Science and Technology (Japan) | the Grant to the Cooperative Research Project on Clinical and Epidemiological Studies of Emerging and Reemerging Infectious Diseases (Renkei Jigyo) |  日本 日本 | | National Institutes of Health/National Center for Research Resources (NIH/NCRR) | |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2017 ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2017
タイトル: Design, synthesis, X-ray studies, and biological evaluation of novel macrocyclic HIV-1 protease inhibitors involving the P1'-P2' ligands.
著者: Ghosh, A.K. / Sean Fyvie, W. / Brindisi, M. / Steffey, M. / Agniswamy, J. / Wang, Y.F. / Aoki, M. / Amano, M. / Weber, I.T. / Mitsuya, H. |
|---|
| 履歴 | | 登録 | 2017年7月27日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2017年10月11日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2017年10月18日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support |
|---|
| 改定 1.2 | 2017年10月25日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.3 | 2019年12月4日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.4 | 2023年10月4日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr2_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.27 Å
分子置換 / 解像度: 1.27 Å  データ登録者
データ登録者 米国,
米国,  日本, 7件
日本, 7件  引用
引用 ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2017
ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2017 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5wlo.cif.gz
5wlo.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5wlo.ent.gz
pdb5wlo.ent.gz PDB形式
PDB形式 5wlo.json.gz
5wlo.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5wlo_validation.pdf.gz
5wlo_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5wlo_full_validation.pdf.gz
5wlo_full_validation.pdf.gz 5wlo_validation.xml.gz
5wlo_validation.xml.gz 5wlo_validation.cif.gz
5wlo_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/wl/5wlo
https://data.pdbj.org/pub/pdb/validation_reports/wl/5wlo ftp://data.pdbj.org/pub/pdb/validation_reports/wl/5wlo
ftp://data.pdbj.org/pub/pdb/validation_reports/wl/5wlo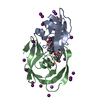
 リンク
リンク 集合体
集合体
 要素
要素
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)


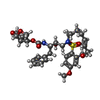








 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-BM / 波長: 1 Å
/ ビームライン: 22-BM / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj




