[English] 日本語
 Yorodumi
Yorodumi- PDB-5whk: Crystal structure of Fab fragment of antibody DX-2507 bound to Fc... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5whk | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of Fab fragment of antibody DX-2507 bound to FcRn-B2M | ||||||
 Components Components |
| ||||||
 Keywords Keywords | IMMUNE SYSTEM / neonatal receptor / Fc / antibody recycling | ||||||
| Function / homology |  Function and homology information Function and homology informationIgG immunoglobulin transcytosis in epithelial cells mediated by FcRn immunoglobulin receptor / IgG binding / immunoglobulin complex / beta-2-microglobulin binding / negative regulation of receptor binding / early endosome lumen / Nef mediated downregulation of MHC class I complex cell surface expression / DAP12 interactions / transferrin transport / cellular response to iron ion ...IgG immunoglobulin transcytosis in epithelial cells mediated by FcRn immunoglobulin receptor / IgG binding / immunoglobulin complex / beta-2-microglobulin binding / negative regulation of receptor binding / early endosome lumen / Nef mediated downregulation of MHC class I complex cell surface expression / DAP12 interactions / transferrin transport / cellular response to iron ion / Endosomal/Vacuolar pathway / Antigen Presentation: Folding, assembly and peptide loading of class I MHC / peptide antigen assembly with MHC class II protein complex / cellular response to iron(III) ion / MHC class II protein complex / negative regulation of forebrain neuron differentiation / antigen processing and presentation of exogenous protein antigen via MHC class Ib, TAP-dependent / ER to Golgi transport vesicle membrane / peptide antigen assembly with MHC class I protein complex / regulation of iron ion transport / regulation of erythrocyte differentiation / HFE-transferrin receptor complex / response to molecule of bacterial origin / MHC class I peptide loading complex / T cell mediated cytotoxicity / positive regulation of T cell cytokine production / antigen processing and presentation of endogenous peptide antigen via MHC class I / antigen processing and presentation of exogenous peptide antigen via MHC class II / positive regulation of immune response / MHC class I protein complex / positive regulation of T cell activation / peptide antigen binding / positive regulation of receptor-mediated endocytosis / negative regulation of neurogenesis / cellular response to nicotine / positive regulation of T cell mediated cytotoxicity / multicellular organismal-level iron ion homeostasis / specific granule lumen / phagocytic vesicle membrane / recycling endosome membrane / Interferon gamma signaling / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / negative regulation of epithelial cell proliferation / MHC class II protein complex binding / Modulation by Mtb of host immune system / late endosome membrane / sensory perception of smell / positive regulation of cellular senescence / tertiary granule lumen / DAP12 signaling / T cell differentiation in thymus / negative regulation of neuron projection development / ER-Phagosome pathway / protein refolding / early endosome membrane / protein homotetramerization / adaptive immune response / amyloid fibril formation / intracellular iron ion homeostasis / learning or memory / endosome membrane / immune response / endoplasmic reticulum lumen / Amyloid fiber formation / Golgi membrane / lysosomal membrane / external side of plasma membrane / focal adhesion / Neutrophil degranulation / SARS-CoV-2 activates/modulates innate and adaptive immune responses / structural molecule activity / endoplasmic reticulum / Golgi apparatus / protein homodimerization activity / extracellular space / extracellular exosome / extracellular region / identical protein binding / membrane / plasma membrane / cytosol Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 2.5 Å molecular replacement / Resolution: 2.5 Å | ||||||
 Authors Authors | Edwards, T.E. / Clifton, M.C. / Nixon, A.E. / Kenniston, J.A. | ||||||
 Citation Citation |  Journal: J. Biol. Chem. / Year: 2017 Journal: J. Biol. Chem. / Year: 2017Title: Structural basis for pH-insensitive inhibition of immunoglobulin G recycling by an anti-neonatal Fc receptor antibody. Authors: Kenniston, J.A. / Taylor, B.M. / Conley, G.P. / Cosic, J. / Kopacz, K.J. / Lindberg, A.P. / Comeau, S.R. / Atkins, K. / Bullen, J. / TenHoor, C. / Adelman, B.A. / Sexton, D.J. / Edwards, T.E. / Nixon, A.E. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5whk.cif.gz 5whk.cif.gz | 322.2 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5whk.ent.gz pdb5whk.ent.gz | 256.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5whk.json.gz 5whk.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  5whk_validation.pdf.gz 5whk_validation.pdf.gz | 469.7 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  5whk_full_validation.pdf.gz 5whk_full_validation.pdf.gz | 473.4 KB | Display | |
| Data in XML |  5whk_validation.xml.gz 5whk_validation.xml.gz | 30.6 KB | Display | |
| Data in CIF |  5whk_validation.cif.gz 5whk_validation.cif.gz | 43.9 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/wh/5whk https://data.pdbj.org/pub/pdb/validation_reports/wh/5whk ftp://data.pdbj.org/pub/pdb/validation_reports/wh/5whk ftp://data.pdbj.org/pub/pdb/validation_reports/wh/5whk | HTTPS FTP |
-Related structure data
| Related structure data |  5whjSC  3m17S S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 2 molecules AB
| #3: Protein | Mass: 32824.039 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: FCGRT, FCRN / Production host: Homo sapiens (human) / Gene: FCGRT, FCRN / Production host:  |
|---|---|
| #4: Protein | Mass: 13732.547 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: B2M, CDABP0092, HDCMA22P / Production host: Homo sapiens (human) / Gene: B2M, CDABP0092, HDCMA22P / Production host:  |
-Antibody , 2 types, 2 molecules HL
| #1: Antibody | Mass: 22981.740 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Production host: Homo sapiens (human) / Production host:  Homo sapiens (human) / References: UniProt: S6BAN1 Homo sapiens (human) / References: UniProt: S6BAN1 |
|---|---|
| #2: Antibody | Mass: 22659.986 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Production host: Homo sapiens (human) / Production host:  Homo sapiens (human) / References: UniProt: Q6NS95 Homo sapiens (human) / References: UniProt: Q6NS95 |
-Non-polymers , 3 types, 258 molecules 
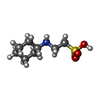



| #5: Chemical | | #6: Chemical | #7: Water | ChemComp-HOH / | |
|---|
-Details
| Has protein modification | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.92 Å3/Da / Density % sol: 57.86 % |
|---|---|
| Crystal grow | Temperature: 289 K / Method: vapor diffusion, sitting drop / pH: 7.5 Details: DX-2507 Fab FcRn B2M complex at 6.6 mg/mL at 70 uM against an optimization screen against JCSG+ A7 18% PEG 8000, 0.1 M CHES pH 9.8 with seeding from an earlier crystal obtained under similar ...Details: DX-2507 Fab FcRn B2M complex at 6.6 mg/mL at 70 uM against an optimization screen against JCSG+ A7 18% PEG 8000, 0.1 M CHES pH 9.8 with seeding from an earlier crystal obtained under similar conditions, supplemented with 20% ethylene glycol as cro-protectant |
-Data collection
| Diffraction | Mean temperature: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 21-ID-F / Wavelength: 0.97872 Å / Beamline: 21-ID-F / Wavelength: 0.97872 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: MARMOSAIC 300 mm CCD / Detector: CCD / Date: Aug 20, 2015 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.97872 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.5→47.429 Å / Num. obs: 38312 / % possible obs: 99.8 % / Observed criterion σ(I): -3 / Redundancy: 4.888 % / Biso Wilson estimate: 44.85 Å2 / CC1/2: 0.998 / Rmerge(I) obs: 0.072 / Rrim(I) all: 0.081 / Χ2: 0.991 / Net I/σ(I): 16.26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement |
|---|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 3M17, 5WHJ Resolution: 2.5→47.429 Å / SU ML: 0.33 / Cross valid method: THROUGHOUT / σ(F): 1.35 / Phase error: 24.37
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 119.05 Å2 / Biso mean: 49.4345 Å2 / Biso min: 20.32 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.5→47.429 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 14
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj




