[English] 日本語
 Yorodumi
Yorodumi- PDB-5tj7: Structure of WWP2 WW2-2,3-linker-HECT aa 334-398 linked to 485-865 -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5tj7 | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of WWP2 WW2-2,3-linker-HECT aa 334-398 linked to 485-865 | ||||||
 Components Components | NEDD4-like E3 ubiquitin-protein ligase WWP2 | ||||||
 Keywords Keywords | TRANSFERASE / WWP2 / HECT Domain / WW2 / WWP1 / ITCH / autoinhibition | ||||||
| Function / homology |  Function and homology information Function and homology informationnegative regulation of transporter activity / negative regulation of protein transport / extracellular transport / negative regulation of potassium ion export across plasma membrane / potassium channel inhibitor activity / regulation of monoatomic ion transmembrane transport / HECT-type E3 ubiquitin transferase / transcription factor binding / RHOJ GTPase cycle / RHOQ GTPase cycle ...negative regulation of transporter activity / negative regulation of protein transport / extracellular transport / negative regulation of potassium ion export across plasma membrane / potassium channel inhibitor activity / regulation of monoatomic ion transmembrane transport / HECT-type E3 ubiquitin transferase / transcription factor binding / RHOJ GTPase cycle / RHOQ GTPase cycle / RHOU GTPase cycle / negative regulation of Notch signaling pathway / protein K63-linked ubiquitination / ubiquitin ligase complex / transcription regulator inhibitor activity / protein autoubiquitination / regulation of membrane potential / NOTCH3 Activation and Transmission of Signal to the Nucleus / protein modification process / Regulation of PTEN stability and activity / ubiquitin-protein transferase activity / ubiquitin protein ligase activity / proteasome-mediated ubiquitin-dependent protein catabolic process / RNA polymerase II-specific DNA-binding transcription factor binding / transmembrane transporter binding / transcription by RNA polymerase II / protein ubiquitination / negative regulation of gene expression / negative regulation of DNA-templated transcription / symbiont entry into host cell / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / extracellular exosome / nucleus / membrane / cytosol / cytoplasm Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 2.6 Å MOLECULAR REPLACEMENT / Resolution: 2.6 Å | ||||||
 Authors Authors | Chen, Z. / Gabelli, S.B. | ||||||
 Citation Citation |  Journal: Mol. Cell / Year: 2017 Journal: Mol. Cell / Year: 2017Title: A Tunable Brake for HECT Ubiquitin Ligases. Authors: Chen, Z. / Jiang, H. / Xu, W. / Li, X. / Dempsey, D.R. / Zhang, X. / Devreotes, P. / Wolberger, C. / Amzel, L.M. / Gabelli, S.B. / Cole, P.A. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5tj7.cif.gz 5tj7.cif.gz | 393.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5tj7.ent.gz pdb5tj7.ent.gz | 317.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5tj7.json.gz 5tj7.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/tj/5tj7 https://data.pdbj.org/pub/pdb/validation_reports/tj/5tj7 ftp://data.pdbj.org/pub/pdb/validation_reports/tj/5tj7 ftp://data.pdbj.org/pub/pdb/validation_reports/tj/5tj7 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5tj8C  5tjqSC C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| Unit cell |
|
- Components
Components
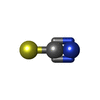
| #1: Protein | Mass: 53441.539 Da / Num. of mol.: 4 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: WWP2 / Plasmid: pGEX6P-2 / Production host: Homo sapiens (human) / Gene: WWP2 / Plasmid: pGEX6P-2 / Production host:  References: UniProt: O00308, HECT-type E3 ubiquitin transferase #2: Chemical | #3: Chemical | ChemComp-SCN / | #4: Chemical | ChemComp-CL / | #5: Water | ChemComp-HOH / | Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.05 Å3/Da / Density % sol: 40.02 % |
|---|---|
| Crystal grow | Temperature: 291 K / Method: vapor diffusion Details: 0.1 M potassium thiocyanate, 30% PEG monomethyl ether 2000 |
-Data collection
| Diffraction | Mean temperature: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU FR-E+ DW / Wavelength: 1.5417 Å ROTATING ANODE / Type: RIGAKU FR-E+ DW / Wavelength: 1.5417 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: DECTRIS PILATUS 2M / Detector: PIXEL / Date: May 18, 2016 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 1.5417 Å / Relative weight: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.6→50 Å / Num. obs: 47592 / % possible obs: 91.2 % / Redundancy: 2.1 % / Rmerge(I) obs: 0.053 / Rpim(I) all: 0.044 / Rrim(I) all: 0.069 / Χ2: 3.418 / Net I/σ(I): 16.6 / Num. measured all: 101067 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 5TJQ Resolution: 2.6→50 Å / Cor.coef. Fo:Fc: 0.901 / Cor.coef. Fo:Fc free: 0.82 / WRfactor Rfree: 0.2836 / WRfactor Rwork: 0.2072 / FOM work R set: 0.8045 / SU B: 13.025 / SU ML: 0.286 / SU Rfree: 0.4633 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R Free: 0.463 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : REFINED INDIVIDUALLY
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 54.4 Å2 / Biso mean: 23.905 Å2 / Biso min: 6.41 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.6→50 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.601→2.669 Å / Rfactor Rfree error: 0 / Total num. of bins used: 20
|
 Movie
Movie Controller
Controller












 PDBj
PDBj