[English] 日本語
 Yorodumi
Yorodumi- PDB-5tdm: TEV Cleaved Human ATP Citrate Lyase Bound to 4R-Hydroxycitrate and ADP -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5tdm | ||||||
|---|---|---|---|---|---|---|---|
| Title | TEV Cleaved Human ATP Citrate Lyase Bound to 4R-Hydroxycitrate and ADP | ||||||
 Components Components | (ATP-citrate synthase) x 2 | ||||||
 Keywords Keywords | TRANSFERASE / TEV cleaved / ATP-grasp fold / 4R hydroxycitrate binding | ||||||
| Function / homology |  Function and homology information Function and homology informationATP citrate synthase / ATP citrate synthase activity / citrate metabolic process / Fatty acyl-CoA biosynthesis / acetyl-CoA biosynthetic process / ChREBP activates metabolic gene expression / coenzyme A metabolic process / oxaloacetate metabolic process / negative regulation of ferroptosis / cholesterol biosynthetic process ...ATP citrate synthase / ATP citrate synthase activity / citrate metabolic process / Fatty acyl-CoA biosynthesis / acetyl-CoA biosynthetic process / ChREBP activates metabolic gene expression / coenzyme A metabolic process / oxaloacetate metabolic process / negative regulation of ferroptosis / cholesterol biosynthetic process / lipid biosynthetic process / fatty acid biosynthetic process / azurophil granule lumen / ficolin-1-rich granule lumen / ciliary basal body / Neutrophil degranulation / extracellular exosome / extracellular region / nucleoplasm / ATP binding / metal ion binding / membrane / cytosol Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / Resolution: 2.1 Å SYNCHROTRON / Resolution: 2.1 Å | ||||||
 Authors Authors | Hu, J. / Fraser, M.E. | ||||||
 Citation Citation |  Journal: Acta Crystallogr D Struct Biol / Year: 2017 Journal: Acta Crystallogr D Struct Biol / Year: 2017Title: Binding of hydroxycitrate to human ATP-citrate lyase. Authors: Hu, J. / Komakula, A. / Fraser, M.E. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5tdm.cif.gz 5tdm.cif.gz | 441.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5tdm.ent.gz pdb5tdm.ent.gz | 365.8 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5tdm.json.gz 5tdm.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/td/5tdm https://data.pdbj.org/pub/pdb/validation_reports/td/5tdm ftp://data.pdbj.org/pub/pdb/validation_reports/td/5tdm ftp://data.pdbj.org/pub/pdb/validation_reports/td/5tdm | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5tdeC  5tdfC  5tdzC  5te1C  5teqC  5tesC  5tetC C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 2 molecules AB
| #1: Protein | Mass: 47836.633 Da / Num. of mol.: 1 / Fragment: unp residues 1-425 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: ACLY / Production host: Homo sapiens (human) / Gene: ACLY / Production host:  |
|---|---|
| #2: Protein | Mass: 35421.570 Da / Num. of mol.: 1 / Fragment: unp residues 488-810 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: ACLY / Production host: Homo sapiens (human) / Gene: ACLY / Production host:  |
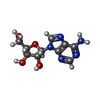
-Non-polymers , 6 types, 194 molecules 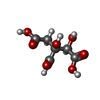









| #3: Chemical | ChemComp-7A2 / | ||||||
|---|---|---|---|---|---|---|---|
| #4: Chemical | ChemComp-ADP / | ||||||
| #5: Chemical | | #6: Chemical | ChemComp-ADN / | #7: Chemical | #8: Water | ChemComp-HOH / | |
-Details
| Has protein modification | Y |
|---|---|
| Sequence details | THE AMINO-TERMINAL PORTION OF HUMAN ACLY WAS REDESIGNED TO HAVE TEV PROTEASE CLEAVAGE SITES ...THE AMINO-TERMINAL PORTION OF HUMAN ACLY WAS REDESIGNED |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.73 Å3/Da / Density % sol: 55.02 % |
|---|---|
| Crystal grow | Temperature: 294 K / Method: vapor diffusion, hanging drop Details: 13% P3350, 100 mM TrisHCl pH 8.7, 125 mM ammonium chloride |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  CLSI CLSI  / Beamline: 08ID-1 / Wavelength: 1.00003 Å / Beamline: 08ID-1 / Wavelength: 1.00003 Å |
| Detector | Type: MARMOSAIC 300 mm CCD / Detector: CCD / Date: Apr 16, 2016 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.00003 Å / Relative weight: 1 |
| Reflection | Resolution: 2.1→63.77 Å / Num. obs: 53911 / % possible obs: 99.7 % / Redundancy: 5.1 % / Net I/σ(I): 8.3 |
- Processing
Processing
| Software | Name: PHENIX / Version: (1.10_2152: ???) / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Resolution: 2.1→63.77 Å / SU ML: 0.31 / Cross valid method: FREE R-VALUE / σ(F): 1.33 / Phase error: 37.52
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.1→63.77 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj







