| 登録情報 | データベース: PDB / ID: 5t05
|
|---|
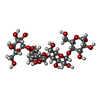
| タイトル | Crystal structure of heparan sulfate 6-O-sulfotransferase with bound PAP and IdoA2S containing hexasaccharide substrate |
|---|
 要素 要素 | maltose binding protein - heparan sulfate 6-O-sulfotransferase isoform 3 fusion protein |
|---|
 キーワード キーワード | TRANSFERASE / heparan sulfate / sulfotransferase / complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
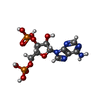
heparan sulfate 6-sulfotransferase activity / HS-GAG biosynthesis / 転移酵素; 硫黄を含む基を移すもの; スルホトランスキナーゼ類 / : / 3'-phosphoadenosine 5'-phosphosulfate binding / sulfotransferase activity / oligosaccharide binding / detection of maltose stimulus / maltose transport complex / carbohydrate transport ...heparan sulfate 6-sulfotransferase activity / HS-GAG biosynthesis / 転移酵素; 硫黄を含む基を移すもの; スルホトランスキナーゼ類 / : / 3'-phosphoadenosine 5'-phosphosulfate binding / sulfotransferase activity / oligosaccharide binding / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex / cell chemotaxis / outer membrane-bounded periplasmic space / periplasmic space / DNA damage response / membrane類似検索 - 分子機能 Heparan sulphate 6-sulfotransferase/Protein-tyrosine sulfotransferase / Sulfotransferase / Sulfotransferase family / Maltose/Cyclodextrin ABC transporter, substrate-binding protein / Solute-binding family 1, conserved site / Bacterial extracellular solute-binding proteins, family 1 signature. / Bacterial extracellular solute-binding protein / Bacterial extracellular solute-binding protein / P-loop containing nucleotide triphosphate hydrolases / Rossmann fold ...Heparan sulphate 6-sulfotransferase/Protein-tyrosine sulfotransferase / Sulfotransferase / Sulfotransferase family / Maltose/Cyclodextrin ABC transporter, substrate-binding protein / Solute-binding family 1, conserved site / Bacterial extracellular solute-binding proteins, family 1 signature. / Bacterial extracellular solute-binding protein / Bacterial extracellular solute-binding protein / P-loop containing nucleotide triphosphate hydrolases / Rossmann fold / P-loop containing nucleoside triphosphate hydrolase / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 alpha-maltotetraose / ADENOSINE-3'-5'-DIPHOSPHATE / P-NITROPHENOL / L(+)-TARTARIC ACID / Heparan-sulfate 6-O-sulfotransferase 3-B / Maltose/maltodextrin-binding periplasmic protein / Maltose/maltodextrin-binding periplasmic protein類似検索 - 構成要素 |
|---|
| 生物種 |   Escherichia coli O157:H7 (大腸菌) Escherichia coli O157:H7 (大腸菌)
  Danio rerio (ゼブラフィッシュ) Danio rerio (ゼブラフィッシュ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.952 Å 分子置換 / 解像度: 1.952 Å |
|---|
 データ登録者 データ登録者 | Pedersen, L.C. / Moon, A.F. / krahn, J.M. / Liu, J. |
|---|
| 資金援助 |  米国, 2件 米国, 2件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM102137 |  米国 米国 | | National Institutes of Health/National Heart, Lung, and Blood Institute (NIH/NHLBI) | HL094463 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: ACS Chem. Biol. / 年: 2017 ジャーナル: ACS Chem. Biol. / 年: 2017
タイトル: Structure Based Substrate Specificity Analysis of Heparan Sulfate 6-O-Sulfotransferases.
著者: Xu, Y. / Moon, A.F. / Xu, S. / Krahn, J.M. / Liu, J. / Pedersen, L.C. |
|---|
| 履歴 | | 登録 | 2016年8月15日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2017年2月1日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2017年9月20日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.2 | 2019年12月4日 | Group: Author supporting evidence / Data collection / カテゴリ: chem_comp / pdbx_audit_support
Item: _chem_comp.type / _pdbx_audit_support.funding_organization |
|---|
| 改定 2.0 | 2020年7月29日 | Group: Advisory / Atomic model ...Advisory / Atomic model / Data collection / Derived calculations / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / entity / entity_name_com / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_molecule_features / pdbx_nonpoly_scheme / pdbx_struct_assembly_gen / pdbx_struct_conn_angle / pdbx_unobs_or_zero_occ_atoms / struct_asym / struct_conn / struct_conn_type / struct_site / struct_site_gen
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_alt_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.occupancy / _atom_site.type_symbol / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _pdbx_struct_assembly_gen.asym_id_list / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_asym_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _pdbx_unobs_or_zero_occ_atoms.label_asym_id / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_ptnr1_label_alt_id / _struct_conn.pdbx_ptnr2_label_alt_id / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn_type.id
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.1 | 2024年11月13日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature / struct_conn
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI ..._chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_leaving_atom_flag |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報

 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.952 Å
分子置換 / 解像度: 1.952 Å  データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: ACS Chem. Biol. / 年: 2017
ジャーナル: ACS Chem. Biol. / 年: 2017 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5t05.cif.gz
5t05.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5t05.ent.gz
pdb5t05.ent.gz PDB形式
PDB形式 5t05.json.gz
5t05.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/t0/5t05
https://data.pdbj.org/pub/pdb/validation_reports/t0/5t05 ftp://data.pdbj.org/pub/pdb/validation_reports/t0/5t05
ftp://data.pdbj.org/pub/pdb/validation_reports/t0/5t05 リンク
リンク 集合体
集合体


 要素
要素












 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 1 Å
/ ビームライン: 22-ID / 波長: 1 Å 解析
解析 分子置換 / 解像度: 1.952→38.487 Å / SU ML: 0.2 / 交差検証法: THROUGHOUT / σ(F): 1.34 / 位相誤差: 21.7 / 立体化学のターゲット値: ML
分子置換 / 解像度: 1.952→38.487 Å / SU ML: 0.2 / 交差検証法: THROUGHOUT / σ(F): 1.34 / 位相誤差: 21.7 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj