+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5bup | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
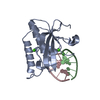
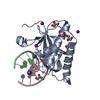
| タイトル | Crystal structure of the ZP-C domain of mouse ZP2 | ||||||||||||||||||||||||
 要素 要素 | Zona pellucida sperm-binding protein 2 | ||||||||||||||||||||||||
 キーワード キーワード | CELL ADHESION / Sperm receptor / immunoglobulin-like domain / zona pellucida / ZP domain / protein polymerization | ||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Interaction With Cumulus Cells And The Zona Pellucida / acrosin binding / structural constituent of egg coat / egg coat / prevention of polyspermy / binding of sperm to zona pellucida / multivesicular body / : / endoplasmic reticulum / extracellular region ...Interaction With Cumulus Cells And The Zona Pellucida / acrosin binding / structural constituent of egg coat / egg coat / prevention of polyspermy / binding of sperm to zona pellucida / multivesicular body / : / endoplasmic reticulum / extracellular region / identical protein binding / plasma membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||
| 生物種 |  | ||||||||||||||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.251 Å 分子置換 / 解像度: 2.251 Å | ||||||||||||||||||||||||
 データ登録者 データ登録者 | Nishimura, K. / Jovine, L. | ||||||||||||||||||||||||
| 資金援助 |  スウェーデン, 7件 スウェーデン, 7件
| ||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2016 ジャーナル: Proc Natl Acad Sci U S A / 年: 2016タイトル: A structured interdomain linker directs self-polymerization of human uromodulin. 著者: Marcel Bokhove / Kaoru Nishimura / Martina Brunati / Ling Han / Daniele de Sanctis / Luca Rampoldi / Luca Jovine /    要旨: Uromodulin (UMOD)/Tamm-Horsfall protein, the most abundant human urinary protein, plays a key role in chronic kidney diseases and is a promising therapeutic target for hypertension. Via its bipartite ...Uromodulin (UMOD)/Tamm-Horsfall protein, the most abundant human urinary protein, plays a key role in chronic kidney diseases and is a promising therapeutic target for hypertension. Via its bipartite zona pellucida module (ZP-N/ZP-C), UMOD forms extracellular filaments that regulate kidney electrolyte balance and innate immunity, as well as protect against renal stones. Moreover, salt-dependent aggregation of UMOD filaments in the urine generates a soluble molecular net that captures uropathogenic bacteria and facilitates their clearance. Despite the functional importance of its homopolymers, no structural information is available on UMOD and how it self-assembles into filaments. Here, we report the crystal structures of polymerization regions of human UMOD and mouse ZP2, an essential sperm receptor protein that is structurally related to UMOD but forms heteropolymers. The structure of UMOD reveals that an extensive hydrophobic interface mediates ZP-N domain homodimerization. This arrangement is required for filament formation and is directed by an ordered ZP-N/ZP-C linker that is not observed in ZP2 but is conserved in the sequence of deafness/Crohn's disease-associated homopolymeric glycoproteins α-tectorin (TECTA) and glycoprotein 2 (GP2). Our data provide an example of how interdomain linker plasticity can modulate the function of structurally similar multidomain proteins. Moreover, the architecture of UMOD rationalizes numerous pathogenic mutations in both UMOD and TECTA genes. #1: ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 1980 タイトル: Synthesis of zona pellucida proteins by denuded and follicle-enclosed mouse oocytes during culture in vitro. 著者: Bleil, J.D. / Wassarman, P.M. #2: ジャーナル: Dev. Biol. / 年: 1981 タイトル: Mammalian sperm-egg interaction: fertilization of mouse eggs triggers modification of the major zona pellucida glycoprotein, ZP2. 著者: Bleil, J.D. / Beall, C.F. / Wassarman, P.M. #3: ジャーナル: J. Biol. Chem. / 年: 2003 タイトル: Structural characterization of native mouse zona pellucida proteins using mass spectrometry. 著者: Boja, E.S. / Hoodbhoy, T. / Fales, H.M. / Dean, J. #4: ジャーナル: Mol. Reprod. Dev. / 年: 2008 タイトル: Disulfide linkage patterns of pig zona pellucida glycoproteins ZP3 and ZP4. 著者: Kanai, S. / Kitayama, T. / Yonezawa, N. / Sawano, Y. / Tanokura, M. / Nakano, M. #5:  ジャーナル: Cell / 年: 2010 ジャーナル: Cell / 年: 2010タイトル: Insights into egg coat assembly and egg-sperm interaction from the X-ray structure of full-length ZP3. 著者: Ling Han / Magnus Monné / Hiroki Okumura / Thomas Schwend / Amy L Cherry / David Flot / Tsukasa Matsuda / Luca Jovine /  要旨: ZP3, a major component of the zona pellucida (ZP) matrix coating mammalian eggs, is essential for fertilization by acting as sperm receptor. By retaining a propeptide that contains a polymerization- ...ZP3, a major component of the zona pellucida (ZP) matrix coating mammalian eggs, is essential for fertilization by acting as sperm receptor. By retaining a propeptide that contains a polymerization-blocking external hydrophobic patch (EHP), we determined the crystal structure of an avian homolog of ZP3 at 2.0 Å resolution. The structure unveils the fold of a complete ZP domain module in a homodimeric arrangement required for secretion and reveals how EHP prevents premature incorporation of ZP3 into the ZP. This suggests mechanisms underlying polymerization and how local structural differences, reflected by alternative disulfide patterns, control the specificity of ZP subunit interaction. Close relative positioning of a conserved O-glycan important for sperm binding and the hypervariable, positively selected C-terminal region of ZP3 suggests a concerted role in the regulation of species-restricted gamete recognition. Alternative conformations of the area around the O-glycan indicate how sperm binding could trigger downstream events via intramolecular signaling. | ||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5bup.cif.gz 5bup.cif.gz | 109.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5bup.ent.gz pdb5bup.ent.gz | 84.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5bup.json.gz 5bup.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5bup_validation.pdf.gz 5bup_validation.pdf.gz | 431.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5bup_full_validation.pdf.gz 5bup_full_validation.pdf.gz | 432.2 KB | 表示 | |
| XML形式データ |  5bup_validation.xml.gz 5bup_validation.xml.gz | 8.6 KB | 表示 | |
| CIF形式データ |  5bup_validation.cif.gz 5bup_validation.cif.gz | 11.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/bu/5bup https://data.pdbj.org/pub/pdb/validation_reports/bu/5bup ftp://data.pdbj.org/pub/pdb/validation_reports/bu/5bup ftp://data.pdbj.org/pub/pdb/validation_reports/bu/5bup | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 23826.770 Da / 分子数: 1 / 断片: UNP residues 463-664 / 変異: K634N, R635A / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 参照: UniProt: P20239 Homo sapiens (ヒト) / 参照: UniProt: P20239 | ||||
|---|---|---|---|---|---|
| #2: 化合物 | | #3: 水 | ChemComp-HOH / | Has protein modification | Y | |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.7 Å3/Da / 溶媒含有率: 54.5 % / 解説: Needle |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.5 詳細: 25% PEG 3350, 0.1 M sodium acetate pH 5.5, 0.2 M ammonium sulfate, 20% glycerol |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Diamond Diamond  / ビームライン: I02 / 波長: 0.97939 Å / ビームライン: I02 / 波長: 0.97939 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2014年11月29日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97939 Å / 相対比: 1 |
| 反射 | 解像度: 2.25057→45.5573 Å / Num. obs: 12293 / % possible obs: 95 % / 冗長度: 3.4 % / Rmerge(I) obs: 0.1022 / Net I/σ(I): 9.74 |
| 反射 シェル | 解像度: 2.251→2.332 Å / 冗長度: 3.3 % / Mean I/σ(I) obs: 1.19 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 2.251→37.05 Å / SU ML: 0.33 / 交差検証法: FREE R-VALUE / σ(F): 0 / 位相誤差: 26.02 / 立体化学のターゲット値: ML 分子置換 / 解像度: 2.251→37.05 Å / SU ML: 0.33 / 交差検証法: FREE R-VALUE / σ(F): 0 / 位相誤差: 26.02 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.6 Å / VDWプローブ半径: 0.9 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.251→37.05 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 詳細: Chain A / 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj


