+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4nqs | ||||||
|---|---|---|---|---|---|---|---|
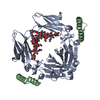
| Title | Knob-into-hole IgG Fc | ||||||
 Components Components |
| ||||||
 Keywords Keywords | IMMUNE SYSTEM / immunoglobulin | ||||||
| Function / homology |  Function and homology information Function and homology informationFc-gamma receptor I complex binding / complement-dependent cytotoxicity / antibody-dependent cellular cytotoxicity / immunoglobulin receptor binding / IgG immunoglobulin complex / immunoglobulin complex, circulating / Classical antibody-mediated complement activation / Initial triggering of complement / FCGR activation / complement activation, classical pathway ...Fc-gamma receptor I complex binding / complement-dependent cytotoxicity / antibody-dependent cellular cytotoxicity / immunoglobulin receptor binding / IgG immunoglobulin complex / immunoglobulin complex, circulating / Classical antibody-mediated complement activation / Initial triggering of complement / FCGR activation / complement activation, classical pathway / Role of phospholipids in phagocytosis / antigen binding / FCGR3A-mediated IL10 synthesis / Regulation of Complement cascade / B cell receptor signaling pathway / FCGR3A-mediated phagocytosis / Regulation of actin dynamics for phagocytic cup formation / antibacterial humoral response / Interleukin-4 and Interleukin-13 signaling / blood microparticle / adaptive immune response / extracellular space / extracellular exosome / extracellular region / plasma membrane Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) Staphylococcus (bacteria) Staphylococcus (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.64 Å MOLECULAR REPLACEMENT / Resolution: 2.64 Å | ||||||
 Authors Authors | Eigenbrot, C. / Ultsch, M. | ||||||
 Citation Citation |  Journal: J.Mol.Biol. / Year: 2014 Journal: J.Mol.Biol. / Year: 2014Title: Antiparallel Conformation of Knob and Hole Aglycosylated Half-Antibody Homodimers Is Mediated by a CH2-CH3 Hydrophobic Interaction. Authors: Elliott, J.M. / Ultsch, M. / Lee, J. / Tong, R. / Takeda, K. / Spiess, C. / Eigenbrot, C. / Scheer, J.M. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4nqs.cif.gz 4nqs.cif.gz | 397.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4nqs.ent.gz pdb4nqs.ent.gz | 329.2 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4nqs.json.gz 4nqs.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/nq/4nqs https://data.pdbj.org/pub/pdb/validation_reports/nq/4nqs ftp://data.pdbj.org/pub/pdb/validation_reports/nq/4nqs ftp://data.pdbj.org/pub/pdb/validation_reports/nq/4nqs | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4nqtC  4nquC  1l6xS C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 24000.146 Da / Num. of mol.: 2 / Fragment: UNP residues 118-330 / Mutation: T366S/L368A/Y407V Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: IGHG1 / Production host: Homo sapiens (human) / Gene: IGHG1 / Production host:  #2: Protein | Mass: 24205.400 Da / Num. of mol.: 2 / Fragment: UNP residues 118-330 / Mutation: T366W Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: IGHG1 / Production host: Homo sapiens (human) / Gene: IGHG1 / Production host:  #3: Protein/peptide | Mass: 4190.682 Da / Num. of mol.: 4 / Source method: obtained synthetically / Source: (synth.)  Staphylococcus (bacteria) Staphylococcus (bacteria)#4: Water | ChemComp-HOH / | Has protein modification | Y | Sequence details | D356E and L358M (UNP D239E and L241M) ARE NATURAL VARIANTS. | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.37 Å3/Da / Density % sol: 48.12 % |
|---|---|
| Crystal grow | Temperature: 291 K / Method: vapor diffusion, hanging drop / pH: 6.5 Details: 20% PEG2000 MME, 10% 2-propanol, 0.1 M MES, pH 6.5, VAPOR DIFFUSION, HANGING DROP, temperature 291K |
-Data collection
| Diffraction | Mean temperature: 110 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ALS ALS  / Beamline: 5.0.2 / Wavelength: 0.98 Å / Beamline: 5.0.2 / Wavelength: 0.98 Å |
| Detector | Type: ADSC QUANTUM 315r / Detector: CCD / Date: Oct 14, 2009 |
| Radiation | Monochromator: liquid nitrogen cooled dual crystal Si(111) / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.98 Å / Relative weight: 1 |
| Reflection | Resolution: 2.64→50 Å / Num. all: 30484 / Num. obs: 30472 / % possible obs: 97 % / Observed criterion σ(F): 0 / Observed criterion σ(I): -3 / Biso Wilson estimate: 56.12 Å2 |
| Reflection shell | Highest resolution: 2.64 Å |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 1L6X Resolution: 2.64→46.5 Å / Cor.coef. Fo:Fc: 0.8939 / Cor.coef. Fo:Fc free: 0.8583 / Cross valid method: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 2.859 / SU Rfree Blow DPI: 0.345 / Stereochemistry target values: maxIMUM LIKELIHOOD
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 51.74 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.458 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.64→46.5 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.64→2.73 Å / Total num. of bins used: 15
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller










 PDBj
PDBj









