| 登録情報 | データベース: PDB / ID: 4ldo
|
|---|
| タイトル | Structure of beta2 adrenoceptor bound to adrenaline and an engineered nanobody |
|---|
 要素 要素 | - Camelid Antibody Fragment
- Lysozyme, Beta-2 adrenergic receptor
|
|---|
 キーワード キーワード | MEMBRANE PROTEIN/HYDROLASE / G protein coupled receptor / MEMBRANE PROTEIN-HYDROLASE complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
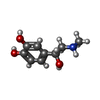
positive regulation of mini excitatory postsynaptic potential / beta2-adrenergic receptor activity / negative regulation of smooth muscle contraction / AMPA selective glutamate receptor signaling pathway / positive regulation of autophagosome maturation / norepinephrine-epinephrine-mediated vasodilation involved in regulation of systemic arterial blood pressure / heat generation / norepinephrine binding / Adrenoceptors / positive regulation of lipophagy ...positive regulation of mini excitatory postsynaptic potential / beta2-adrenergic receptor activity / negative regulation of smooth muscle contraction / AMPA selective glutamate receptor signaling pathway / positive regulation of autophagosome maturation / norepinephrine-epinephrine-mediated vasodilation involved in regulation of systemic arterial blood pressure / heat generation / norepinephrine binding / Adrenoceptors / positive regulation of lipophagy / negative regulation of G protein-coupled receptor signaling pathway / negative regulation of multicellular organism growth / endosome to lysosome transport / adrenergic receptor signaling pathway / response to psychosocial stress / diet induced thermogenesis / positive regulation of cAMP/PKA signal transduction / adenylate cyclase binding / smooth muscle contraction / bone resorption / positive regulation of bone mineralization / potassium channel regulator activity / neuronal dense core vesicle / brown fat cell differentiation / viral release from host cell by cytolysis / intercellular bridge / regulation of sodium ion transport / adenylate cyclase-activating adrenergic receptor signaling pathway / peptidoglycan catabolic process / receptor-mediated endocytosis / response to cold / clathrin-coated endocytic vesicle membrane / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / cellular response to amyloid-beta / cell wall macromolecule catabolic process / Cargo recognition for clathrin-mediated endocytosis / mitotic spindle / lysozyme / lysozyme activity / Clathrin-mediated endocytosis / amyloid-beta binding / positive regulation of cold-induced thermogenesis / microtubule cytoskeleton / G alpha (s) signalling events / transcription by RNA polymerase II / host cell cytoplasm / early endosome / cell surface receptor signaling pathway / endosome membrane / lysosome / receptor complex / Ub-specific processing proteases / endosome / positive regulation of MAPK cascade / defense response to bacterium / ciliary basal body / cilium / apical plasma membrane / protein-containing complex binding / Golgi apparatus / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / identical protein binding / nucleus / membrane / plasma membrane類似検索 - 分子機能 Beta 2 adrenoceptor / Adrenoceptor family / Rhopdopsin 7-helix transmembrane proteins / Rhodopsin 7-helix transmembrane proteins / Lysozyme - #40 / Endolysin T4 type / T4-type lysozyme / : / Glycoside hydrolase, family 24 / Phage lysozyme ...Beta 2 adrenoceptor / Adrenoceptor family / Rhopdopsin 7-helix transmembrane proteins / Rhodopsin 7-helix transmembrane proteins / Lysozyme - #40 / Endolysin T4 type / T4-type lysozyme / : / Glycoside hydrolase, family 24 / Phage lysozyme / Lysozyme domain superfamily / Serpentine type 7TM GPCR chemoreceptor Srsx / Lysozyme / G-protein coupled receptors family 1 signature. / Lysozyme-like domain superfamily / G protein-coupled receptor, rhodopsin-like / GPCR, rhodopsin-like, 7TM / G-protein coupled receptors family 1 profile. / 7 transmembrane receptor (rhodopsin family) / Immunoglobulins / Up-down Bundle / Immunoglobulin-like / Sandwich / Orthogonal Bundle / Mainly Beta / Mainly Alpha類似検索 - ドメイン・相同性 (2S)-2,3-dihydroxypropyl (7Z)-tetradec-7-enoate / L-EPINEPHRINE / Endolysin / Beta-2 adrenergic receptor類似検索 - 構成要素 |
|---|
| 生物種 |  Enterobacteria phage T4 (ファージ) Enterobacteria phage T4 (ファージ)
 Homo sapiens (ヒト) Homo sapiens (ヒト)
  Lama glama (ラマ) Lama glama (ラマ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.2 Å 分子置換 / 解像度: 3.2 Å |
|---|
 データ登録者 データ登録者 | Ring, A.M. / Manglik, A. / Kruse, A.C. / Enos, M.D. / Weis, W.I. / Garcia, K.C. / Kobilka, B.K. |
|---|
 引用 引用 |  ジャーナル: Nature / 年: 2013 ジャーナル: Nature / 年: 2013
タイトル: Adrenaline-activated structure of beta 2-adrenoceptor stabilized by an engineered nanobody.
著者: Ring, A.M. / Manglik, A. / Kruse, A.C. / Enos, M.D. / Weis, W.I. / Garcia, K.C. / Kobilka, B.K. |
|---|
| 履歴 | | 登録 | 2013年6月24日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2013年9月25日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2013年10月30日 | Group: Database references |
|---|
| 改定 1.2 | 2017年8月9日 | Group: Refinement description / Source and taxonomy / カテゴリ: entity_src_gen / software |
|---|
| 改定 1.3 | 2023年9月20日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2024年11月20日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
| Remark 650 | HELIX DETERMINATION METHOD: AUTHOR DETERMINED |
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Enterobacteria phage T4 (ファージ)
Enterobacteria phage T4 (ファージ) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3.2 Å
分子置換 / 解像度: 3.2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nature / 年: 2013
ジャーナル: Nature / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4ldo.cif.gz
4ldo.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4ldo.ent.gz
pdb4ldo.ent.gz PDB形式
PDB形式 4ldo.json.gz
4ldo.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4ldo_validation.pdf.gz
4ldo_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4ldo_full_validation.pdf.gz
4ldo_full_validation.pdf.gz 4ldo_validation.xml.gz
4ldo_validation.xml.gz 4ldo_validation.cif.gz
4ldo_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ld/4ldo
https://data.pdbj.org/pub/pdb/validation_reports/ld/4ldo ftp://data.pdbj.org/pub/pdb/validation_reports/ld/4ldo
ftp://data.pdbj.org/pub/pdb/validation_reports/ld/4ldo リンク
リンク 集合体
集合体
 要素
要素 Enterobacteria phage T4 (ファージ), (組換発現)
Enterobacteria phage T4 (ファージ), (組換発現)  Homo sapiens (ヒト)
Homo sapiens (ヒト)







 X線回折 / 使用した結晶の数: 41
X線回折 / 使用した結晶の数: 41  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 23-ID-D / 波長: 1.033 Å
/ ビームライン: 23-ID-D / 波長: 1.033 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj













