| 登録情報 | データベース: PDB / ID: 4bd1
|
|---|
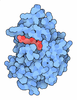
| タイトル | Neutron structure of a perdeuterated Toho-1 R274N R276N double mutant Beta-lactamase in complex with a fully deuterated boronic acid (BZB) |
|---|
 要素 要素 | TOHO-1 BETA-LACTAMASE |
|---|
 キーワード キーワード | HYDROLASE / PERDEUTERATED NEUTRON STRUCTURE / EXTENDED-SPECTRUM BETA LACTAMASES / CTX- M-TYPE ESBLS |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
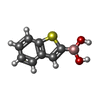
beta-lactam antibiotic catabolic process / beta-lactamase activity / beta-lactamase / response to antibiotic類似検索 - 分子機能 Beta-lactamase, class-A active site / Beta-lactamase class-A active site. / Beta-lactamase class A, catalytic domain / Beta-lactamase enzyme family / Beta-lactamase, class-A / Beta-lactamase / DD-peptidase/beta-lactamase superfamily / Beta-lactamase/transpeptidase-like / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 BENZO[B]THIOPHENE-2-BORONIC ACID / DEUTERATED WATER / Beta-lactamase Toho-1類似検索 - 構成要素 |
|---|
| 生物種 |   ESCHERICHIA COLI BL21 (大腸菌) ESCHERICHIA COLI BL21 (大腸菌) |
|---|
| 手法 | 中性子回折 / NUCLEAR REACTOR / 解像度: 2.002 Å |
|---|
 データ登録者 データ登録者 | Tomanicek, S.J. / Weiss, K.L. / Standaert, R.F. / Ostermann, A. / Schrader, T.E. / Ng, J.D. / Coates, L. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2013 ジャーナル: J.Biol.Chem. / 年: 2013
タイトル: Neutron and X-Ray Crystal Structures of a Perdeuterated Enzyme Inhibitor Complex Reveal the Catalytic Proton Network of the Toho-1 Beta-Lactamase for the Acylation Reaction.
著者: Tomanicek, S.J. / Standaert, R.F. / Weiss, K.L. / Ostermann, A. / Schrader, T.E. / Ng, J.D. / Coates, L. |
|---|
| 履歴 | | 登録 | 2012年10月4日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2013年1月16日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2013年2月27日 | Group: Database references |
|---|
| 改定 1.2 | 2017年3月22日 | Group: Data collection |
|---|
| 改定 1.3 | 2024年11月13日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_entry_details / pdbx_modification_feature / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _pdbx_entry_details.has_protein_modification / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2013
ジャーナル: J.Biol.Chem. / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4bd1.cif.gz
4bd1.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4bd1.ent.gz
pdb4bd1.ent.gz PDB形式
PDB形式 4bd1.json.gz
4bd1.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4bd1_validation.pdf.gz
4bd1_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4bd1_full_validation.pdf.gz
4bd1_full_validation.pdf.gz 4bd1_validation.xml.gz
4bd1_validation.xml.gz 4bd1_validation.cif.gz
4bd1_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/bd/4bd1
https://data.pdbj.org/pub/pdb/validation_reports/bd/4bd1 ftp://data.pdbj.org/pub/pdb/validation_reports/bd/4bd1
ftp://data.pdbj.org/pub/pdb/validation_reports/bd/4bd1 リンク
リンク 集合体
集合体
 要素
要素

 試料調製
試料調製 / ビームライン: BIODIFF / 波長: 2.4
/ ビームライン: BIODIFF / 波長: 2.4  解析
解析 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj