+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3pow | ||||||
|---|---|---|---|---|---|---|---|
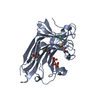
| タイトル | Crystal structure of the globular domain of human calreticulin | ||||||
 要素 要素 | calreticulin | ||||||
 キーワード キーワード | CHAPERONE / legume lectin fold / CNX/CRT family / multi-functional / Carbohydrate binding / Peptide Binding / multi-compartmental | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Calnexin/calreticulin cycle / cytolytic granule / positive regulation of dendritic cell chemotaxis / cortical granule / Assembly of Viral Components at the Budding Site / negative regulation of trophoblast cell migration / ATF6 (ATF6-alpha) activates chaperone genes / negative regulation of retinoic acid receptor signaling pathway / cellular response to electrical stimulus / endoplasmic reticulum quality control compartment ...Calnexin/calreticulin cycle / cytolytic granule / positive regulation of dendritic cell chemotaxis / cortical granule / Assembly of Viral Components at the Budding Site / negative regulation of trophoblast cell migration / ATF6 (ATF6-alpha) activates chaperone genes / negative regulation of retinoic acid receptor signaling pathway / cellular response to electrical stimulus / endoplasmic reticulum quality control compartment / nuclear receptor-mediated glucocorticoid signaling pathway / regulation of meiotic nuclear division / complement component C1q complex binding / sequestering of calcium ion / response to glycoside / sarcoplasmic reticulum lumen / protein folding in endoplasmic reticulum / nuclear export signal receptor activity / negative regulation of intracellular steroid hormone receptor signaling pathway / hormone binding / cardiac muscle cell differentiation / molecular sequestering activity / protein maturation by protein folding / Scavenging by Class F Receptors / Scavenging by Class A Receptors / cortical actin cytoskeleton organization / nuclear androgen receptor binding / cellular response to lithium ion / response to testosterone / protein localization to nucleus / negative regulation of neuron differentiation / smooth endoplasmic reticulum / positive regulation of cell cycle / ERAD pathway / positive regulation of substrate adhesion-dependent cell spreading / protein folding chaperone / positive regulation of phagocytosis / endocytic vesicle lumen / protein export from nucleus / positive regulation of endothelial cell migration / endoplasmic reticulum-Golgi intermediate compartment membrane / acrosomal vesicle / lumenal side of endoplasmic reticulum membrane / Antigen Presentation: Folding, assembly and peptide loading of class I MHC / peptide binding / peptide antigen assembly with MHC class I protein complex / MHC class I peptide loading complex / cellular response to virus / intracellular calcium ion homeostasis / positive regulation of non-canonical NF-kappaB signal transduction / phagocytic vesicle membrane / cellular senescence / unfolded protein binding / integrin binding / protein folding / response to estradiol / nuclear envelope / ER-Phagosome pathway / protein-folding chaperone binding / carbohydrate binding / spermatogenesis / regulation of apoptotic process / collagen-containing extracellular matrix / protein stabilization / negative regulation of translation / ribosome / response to xenobiotic stimulus / iron ion binding / endoplasmic reticulum lumen / external side of plasma membrane / focal adhesion / negative regulation of DNA-templated transcription / mRNA binding / ubiquitin protein ligase binding / calcium ion binding / positive regulation of cell population proliferation / positive regulation of gene expression / regulation of DNA-templated transcription / endoplasmic reticulum membrane / perinuclear region of cytoplasm / negative regulation of transcription by RNA polymerase II / cell surface / endoplasmic reticulum / DNA binding / RNA binding / extracellular space / zinc ion binding / extracellular exosome / extracellular region / membrane / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.55 Å 分子置換 / 解像度: 1.55 Å | ||||||
 データ登録者 データ登録者 | Gaboriaud, C. | ||||||
 引用 引用 |  ジャーナル: Plos One / 年: 2011 ジャーナル: Plos One / 年: 2011タイトル: X-ray structure of the human calreticulin globular domain reveals a Peptide-binding area and suggests a multi-molecular mechanism 著者: Chouquet, A. / Paidassi, H. / Ling, W.L. / Frachet, P. / Houen, G. / Arlaud, G.J. / Gaboriaud, C. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3pow.cif.gz 3pow.cif.gz | 121.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3pow.ent.gz pdb3pow.ent.gz | 90.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3pow.json.gz 3pow.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3pow_validation.pdf.gz 3pow_validation.pdf.gz | 418.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3pow_full_validation.pdf.gz 3pow_full_validation.pdf.gz | 418.8 KB | 表示 | |
| XML形式データ |  3pow_validation.xml.gz 3pow_validation.xml.gz | 14.2 KB | 表示 | |
| CIF形式データ |  3pow_validation.cif.gz 3pow_validation.cif.gz | 21.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/po/3pow https://data.pdbj.org/pub/pdb/validation_reports/po/3pow ftp://data.pdbj.org/pub/pdb/validation_reports/po/3pow ftp://data.pdbj.org/pub/pdb/validation_reports/po/3pow | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 30146.271 Da / 分子数: 1 断片: Globular domain, UNP residues 18-204 and 302-368 linked with GSG 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CALR, CRTC / プラスミド: pHFX-CRT / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CALR, CRTC / プラスミド: pHFX-CRT / 発現宿主:  |
|---|---|
| #2: 化合物 | ChemComp-CA / |
| #3: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.3 Å3/Da / 溶媒含有率: 46.49 % |
|---|---|
| 結晶化 | 温度: 277.1 K / 手法: 蒸気拡散法 / pH: 6 詳細: 30% PEG 4000, 0.2M ammonium acetate, 10mM magnesium acetate, and either 0.05M MES (pH 5.7 or 6.0), or 0.05M HEPES (pH 7.0), VAPOR DIFFUSION, temperature 277.1K |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-2 / 波長: 0.8726 Å / ビームライン: ID23-2 / 波長: 0.8726 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: MARMOSAIC 225 mm CCD / 検出器: CCD / 日付: 2010年4月24日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | モノクロメーター: horizontally side diffracting Silicon 111 crystal プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.8726 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | 数: 6705 / D res high: 1.54 Å / Num. obs: 6705 / % possible obs: 2.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diffraction reflection shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.54→20 Å / Num. all: 39833 / Num. obs: 39833 / % possible obs: 96.8 % / Observed criterion σ(I): -3 / 冗長度: 4.7 % / Biso Wilson estimate: 20.093 Å2 / Rsym value: 0.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 3POS 解像度: 1.55→10 Å / Cor.coef. Fo:Fc: 0.9472 / Cor.coef. Fo:Fc free: 0.9465 / Occupancy max: 1 / Occupancy min: 0.5 / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 78.04 Å2 / Biso mean: 16.0774 Å2 / Biso min: 5.52 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.187 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.55→10 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.55→1.59 Å / Total num. of bins used: 20
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Origin x: 2.1858 Å / Origin y: 10.1515 Å / Origin z: 15.0518 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj









