+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3iz0 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human Ndc80 Bonsai Decorated Microtubule | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | CELL CYCLE / Ndc80 / HEC1 / NUF2 / tubulin / kinetochore / mitosis / calponin homology domain / microtubule | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報G2/MI transition of meiotic cell cycle / kinetochore adaptor activity / skeletal muscle satellite cell proliferation / Ndc80 complex / kinetochore organization / metaphase chromosome alignment / positive regulation of mitotic cell cycle spindle assembly checkpoint / meiotic chromosome segregation / attachment of spindle microtubules to kinetochore / outer kinetochore ...G2/MI transition of meiotic cell cycle / kinetochore adaptor activity / skeletal muscle satellite cell proliferation / Ndc80 complex / kinetochore organization / metaphase chromosome alignment / positive regulation of mitotic cell cycle spindle assembly checkpoint / meiotic chromosome segregation / attachment of spindle microtubules to kinetochore / outer kinetochore / spindle assembly involved in female meiosis I / attachment of mitotic spindle microtubules to kinetochore / positive regulation of axon guidance / mitotic spindle assembly checkpoint signaling / centrosome duplication / establishment of mitotic spindle orientation / mitotic sister chromatid segregation / chromosome, centromeric region / microtubule-based process / cytoplasmic microtubule / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / cellular response to interleukin-4 / cyclin binding / Resolution of Sister Chromatid Cohesion / mitotic spindle organization / chromosome segregation / RHO GTPases Activate Formins / regulation of protein stability / kinetochore / structural constituent of cytoskeleton / microtubule cytoskeleton organization / Separation of Sister Chromatids / neuron migration / mitotic cell cycle / double-stranded RNA binding / microtubule cytoskeleton / microtubule binding / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / microtubule / nuclear speck / cilium / protein heterodimerization activity / cell division / GTPase activity / ubiquitin protein ligase binding / centrosome / GTP binding / protein-containing complex binding / nucleolus / nucleoplasm / metal ion binding / identical protein binding / nucleus / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 8.6 Å | ||||||
 データ登録者 データ登録者 | Alushin, G.M. / Ramey, V.H. / Pasqualato, S. / Ball, D.A. / Grigorieff, N. / Musacchio, A. / Nogales, E. | ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2010 ジャーナル: Nature / 年: 2010タイトル: The Ndc80 kinetochore complex forms oligomeric arrays along microtubules. 著者: Gregory M Alushin / Vincent H Ramey / Sebastiano Pasqualato / David A Ball / Nikolaus Grigorieff / Andrea Musacchio / Eva Nogales /  要旨: The Ndc80 complex is a key site of regulated kinetochore-microtubule attachment (a process required for cell division), but the molecular mechanism underlying its function remains unknown. Here we ...The Ndc80 complex is a key site of regulated kinetochore-microtubule attachment (a process required for cell division), but the molecular mechanism underlying its function remains unknown. Here we present a subnanometre-resolution cryo-electron microscopy reconstruction of the human Ndc80 complex bound to microtubules, sufficient for precise docking of crystal structures of the component proteins. We find that the Ndc80 complex binds the microtubule with a tubulin monomer repeat, recognizing α- and β-tubulin at both intra- and inter-tubulin dimer interfaces in a manner that is sensitive to tubulin conformation. Furthermore, Ndc80 complexes self-associate along protofilaments through interactions mediated by the amino-terminal tail of the NDC80 protein, which is the site of phospho-regulation by Aurora B kinase. The complex's mode of interaction with the microtubule and its oligomerization suggest a mechanism by which Aurora B could regulate the stability of load-bearing kinetochore-microtubule attachments. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3iz0.cif.gz 3iz0.cif.gz | 324.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3iz0.ent.gz pdb3iz0.ent.gz | 252.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3iz0.json.gz 3iz0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3iz0_validation.pdf.gz 3iz0_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3iz0_full_validation.pdf.gz 3iz0_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  3iz0_validation.xml.gz 3iz0_validation.xml.gz | 60.1 KB | 表示 | |
| CIF形式データ |  3iz0_validation.cif.gz 3iz0_validation.cif.gz | 86.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/iz/3iz0 https://data.pdbj.org/pub/pdb/validation_reports/iz/3iz0 ftp://data.pdbj.org/pub/pdb/validation_reports/iz/3iz0 ftp://data.pdbj.org/pub/pdb/validation_reports/iz/3iz0 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
| 詳細 | AUTHORS STATE THAT THE NDC80 COMPLEX FORMS OLIGOMERS ALONG MICROTUBULE PROTOFILAMENTS, BINDING ONCE PER TUBULIN MONOMER. THIS ENTRY CONSISTS OF COORDINATES FOR ONE TUBULIN HETERODIMER BOUND TO A CLUSTER OF 2 NDC80 MOLECULES. THE BINDING SITE IS FORMED BETWEEN TUBULIN MONOMERS, AND THUS THERE IS ONE COMPLETE NDC80-TUBULIN INTERFACE AND ONE NDC80-NDC80 INTERFACE. LARGER CLUSTERS ARE MORE PREVALENT IN VITRO AND ARE LIKELY TO EXIST IN VIVO. |
- 要素
要素
-タンパク質 , 4種, 6分子 ABCEDF
| #1: タンパク質 | 分子量: 50107.238 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||
|---|---|---|---|
| #2: タンパク質 | 分子量: 49907.770 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||
| #3: タンパク質 | 分子量: 36351.297 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NDC80 SPC25, SPBC25, AD024 / プラスミド: pGEX6p-2RBS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NDC80 SPC25, SPBC25, AD024 / プラスミド: pGEX6p-2RBS / 発現宿主:  参照: UniProt: Q05DQ6, UniProt: Q9HBM1, UniProt: O14777*PLUS #4: タンパク質 | 分子量: 28993.418 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NUF2, RP11-77M5.2-004, SPC24 / プラスミド: pGEX6p-2RBS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NUF2, RP11-77M5.2-004, SPC24 / プラスミド: pGEX6p-2RBS / 発現宿主:  参照: UniProt: B1AQT4, UniProt: C9JGC4, UniProt: Q9BZD4*PLUS |
-非ポリマー , 5種, 5分子 



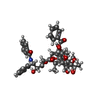



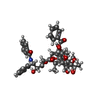
| #5: 化合物 | ChemComp-ZN / |
|---|---|
| #6: 化合物 | ChemComp-MG / |
| #7: 化合物 | ChemComp-GTP / |
| #8: 化合物 | ChemComp-GDP / |
| #9: 化合物 | ChemComp-TA1 / |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.26 MDa / 実験値: NO | |||||||||||||||||||||||||
| 緩衝液 | pH: 6.8 詳細: 80mM PIPES, 1mM MgCl2, 1mM EGTA, 1mM DTT, 0.05% Nonidet P-40, 20uM taxol | |||||||||||||||||||||||||
| 試料 | 濃度: 0.25 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES 詳細: 80mM PIPES, 1mM MgCl2, 1mM EGTA, 1mM DTT, 0.05% Nonidet P-40, 20uM taxol | |||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK I / 凍結剤: ETHANE / 湿度: 100 % 手法: 2ul of 0.25 mg per ml MTs applied to grid for 1 minute 4ul of 0.7 mg per ml Ndc80 bonsai added, 1 minute manually blotted, then another 4ul of Ndc80 applied 1 minute 2ul removed with pipetter ...手法: 2ul of 0.25 mg per ml MTs applied to grid for 1 minute 4ul of 0.7 mg per ml Ndc80 bonsai added, 1 minute manually blotted, then another 4ul of Ndc80 applied 1 minute 2ul removed with pipetter Blot for 2 seconds before plunging, 0mm offset |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI F20 / 日付: 2009年3月12日 |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1200 nm / Cs: 2.2 mm 非点収差: objective lens astigmatism corrected at 100Kx mag カメラ長: 0 mm |
| 試料ホルダ | 試料ホルダーモデル: GATAN LIQUID NITROGEN / 資料ホルダタイプ: side-entry / 傾斜角・最大: 0 ° / 傾斜角・最小: 0 ° |
| 撮影 | 電子線照射量: 15 e/Å2 / フィルム・検出器のモデル: KODAK SO-163 FILM |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 相対比: 1 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3次元再構成 | 手法: IRSHR / 解像度: 8.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF 詳細: Particles were initially aligned using IHRSR protocol in SPIDER with naked MT as reference. Final reconstruction and CTF correction was performed with FREALIGN. A B-factor of -450 was applied ...詳細: Particles were initially aligned using IHRSR protocol in SPIDER with naked MT as reference. Final reconstruction and CTF correction was performed with FREALIGN. A B-factor of -450 was applied with BFACTOR. FSC was calculated only for MT and Ndc80-NUF2 head, disordered outer head was excluded with soft mask. 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||
| 原子モデル構築 |
| ||||||||||||||||||||||||||||||
| 原子モデル構築 | Source name: PDB / タイプ: experimental model
| ||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj













