+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3gat | ||||||
|---|---|---|---|---|---|---|---|
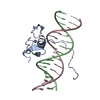
| タイトル | SOLUTION NMR STRUCTURE OF THE C-TERMINAL DOMAIN OF CHICKEN GATA-1 BOUND TO DNA, 34 STRUCTURES | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSCRIPTION/DNA / DNA-BINDING PROTEIN / TRANSCRIPTION FACTOR / ZINC BINDING DOMAIN / TCOMPLEX (TRANSCRIPTION REGULATION-DNA) / TRANSCRIPTION-DNA COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell fate commitment / transcription coactivator binding / DNA-binding transcription factor activity, RNA polymerase II-specific / RNA polymerase II cis-regulatory region sequence-specific DNA binding / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / zinc ion binding / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 溶液NMR / simulated annealing | ||||||
 データ登録者 データ登録者 | Clore, G.M. / Tjandra, N. / Starich, M. / Omichinski, J.G. / Gronenborn, A.M. | ||||||
 引用 引用 |  ジャーナル: Nat.Struct.Biol. / 年: 1997 ジャーナル: Nat.Struct.Biol. / 年: 1997タイトル: Use of dipolar 1H-15N and 1H-13C couplings in the structure determination of magnetically oriented macromolecules in solution. 著者: Tjandra, N. / Omichinski, J.G. / Gronenborn, A.M. / Clore, G.M. / Bax, A. #1:  ジャーナル: J.Mol.Biol. / 年: 1998 ジャーナル: J.Mol.Biol. / 年: 1998タイトル: The solution structure of the Leu22-->Val mutant AREA DNA binding domain complexed with a TGATAG core element defines a role for hydrophobic packing in the determination of specificity 著者: Starich, M.R. / Wikstrom, M. / Shumacher, S. / Arst, H.N. / Gronenborn, A.M. / Clore, G.M. #2:  ジャーナル: Science / 年: 1993 ジャーナル: Science / 年: 1993タイトル: NMR Structure of a Specific DNA Complex of Zn-Containing DNA Binding Domain of Gata-1 著者: Omichinski, J.G. / Clore, G.M. / Schaad, O. / Felsenfeld, G. / Trainor, C. / Appella, E. / Stahl, S.J. / Gronenborn, A.M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3gat.cif.gz 3gat.cif.gz | 1.4 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3gat.ent.gz pdb3gat.ent.gz | 1.1 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3gat.json.gz 3gat.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3gat_validation.pdf.gz 3gat_validation.pdf.gz | 377.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3gat_full_validation.pdf.gz 3gat_full_validation.pdf.gz | 974.5 KB | 表示 | |
| XML形式データ |  3gat_validation.xml.gz 3gat_validation.xml.gz | 59.5 KB | 表示 | |
| CIF形式データ |  3gat_validation.cif.gz 3gat_validation.cif.gz | 104.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ga/3gat https://data.pdbj.org/pub/pdb/validation_reports/ga/3gat ftp://data.pdbj.org/pub/pdb/validation_reports/ga/3gat ftp://data.pdbj.org/pub/pdb/validation_reports/ga/3gat | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: DNA鎖 | 分子量: 4921.228 Da / 分子数: 1 / 由来タイプ: 合成 |
|---|---|
| #2: DNA鎖 | 分子量: 4872.190 Da / 分子数: 1 / 由来タイプ: 合成 |
| #3: タンパク質 | 分子量: 7557.844 Da / 分子数: 1 / Fragment: C-TERMINAL DOMAIN / 由来タイプ: 組換発現 / 由来: (組換発現)   |
| #4: 化合物 | ChemComp-ZN / |
-実験情報
-実験
| 実験 | 手法: 溶液NMR |
|---|---|
| NMR実験の詳細 | Text: DATA WERE RECORDED ON A 1:1 COMPLEX OF 1 MOLECULE OF DNA. |
- 試料調製
試料調製
| 試料状態 | pH: 6.1 / 温度: 298 K |
|---|---|
| 結晶化 | *PLUS 手法: other / 詳細: NMR |
-NMR測定
| NMRスペクトロメーター |
|
|---|
- 解析
解析
| ソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR software |
| ||||||||||||
| 精密化 | 手法: simulated annealing / ソフトェア番号: 1 詳細: THE STRUCTURES WERE CALCULATED USING THE SIMULATED ANNEALING PROTOCOL OF NILGES ET AL. (1988) FEBS LETT. 229, 129 - 136 AND PROTEIN ENGINEERING 2, 27 - 38 USING THE PROGRAM X-PLOR MODIFIED TO ...詳細: THE STRUCTURES WERE CALCULATED USING THE SIMULATED ANNEALING PROTOCOL OF NILGES ET AL. (1988) FEBS LETT. 229, 129 - 136 AND PROTEIN ENGINEERING 2, 27 - 38 USING THE PROGRAM X-PLOR MODIFIED TO INCORPORATE DIPOLAR COUPLING RESTRAINTS (TJANDRA ET AL. (1997) NATURE STRUCT BIOL 4, 732-738) AND A CONFORMATIONAL DATABASE POTENTIAL FOR PROTEINS AND NUCLEIC ACIDS (KUSZEWSKI ET AL. (1996) PROTEIN SCI 5, 1067 - 1080 AND (1997) J. MAGN. RESON. 125, 171-177). THE EXPERIMENTAL RESTRAINTS ARE GIVEN IN R2GATMR. THE STRUCTURES ARE BASED ON A TOTAL OF 1830 EXPERIMENTAL NMR RESTRAINTS COMPRISING: 1444 INTERPROTON DISTANCE RESTRAINTS DERIVED FROM NOE MEASUREMENTS; 296 TORSION ANGLE RESTRAINTS; 90 RESIDUAL DIPOLAR COUPLINGS (52 N-H AND 38 C-H). THE NOE RESTRAINTS ARE SUBDIVIDED AS FOLLOWS: (A) WITHIN THE PROTEIN: 242 INTERRESIDUE SEQUENTIAL (|I-J|=1); 161 INTERRESIDUE SHORT RANGE (1(LESS THAN)|I-J|(LESS THAN)=5); 182 INTERRESIDUE LONG RANGE (|I-J|(GREATER THAN)5); AND 334 INTRARESIDUE. (B) WITHIN THE DNA: 157 INTRARESIDUE; 180 SEQUENTIAL INTRASTRAND; 34 INTERSTRAND; AND 37 H-BONDS (C) BETWEEN PROTEIN AND DNA: 117. THE TORSION ANGLE RESTRAINTS ARE SUBDIVIDED AS FOLLOWS: 144 ANGLES FOR THE PROTEIN (58 PHI, 56 PSI, 26 CHI1 AND 4 CHI2) AND 152 FOR THE DNA. THE TORSION ANGLE RESTRAINTS FOR THE DNA COMPRISE LOOSE RESTRAINTS ON THE BACKBONE TORSION ANGLES ALPHA, BETA, GAMMA, EPSILON AND ZETA TO PREVENT PROBLEMS ASSOCIATED WITH LOCAL MIRROR IMAGES. THE FOLLOWING TWO SETS OF COORDINATES DEFINE THE PRINCIPAL AXIS OF THE MAGNETIC SUSCEPTIBILITY TENSOR: MODEL 1 POINT 1 0.378 -50.982 -38.862 POINT 2 0.472 -49.836 -37.853 MODEL 2 POINT 1 9.054 -65.114 92.057 POINT 2 9.125 -63.952 93.051 MODEL 3 POINT 1 159.392 0.215 -60.612 POINT 2 159.391 1.382 -59.623 MODEL 4 POINT 1 1.446 -13.082 18.709 POINT 2 1.560 -11.891 19.663 MODEL 5 POINT 1 36.350 -69.900 58.948 POINT 2 36.375 -68.721 59.923 MODEL 6 POINT 1 126.484 -20.411 -50.611 POINT 2 126.594 -19.266 -49.602 MODEL 7 POINT 1 88.897 -14.889 116.035 POINT 2 89.009 -13.746 117.045 MODEL 8 POINT 1 33.575 14.467 0.174 POINT 2 33.645 15.627 1.168 MODEL 9 POINT 1 83.455-111.061-109.708 POINT 2 83.524-109.891-108.724 MODEL 10 POINT 1 54.992 12.813 -1.197 POINT 2 55.119 13.958 -0.188 MODEL 11 POINT 1 -5.927 -98.366 8.457 POINT 2 -5.849 -97.197 9.441 MODEL 12 POINT 1 -16.731 -79.619 -28.952 POINT 2 -16.693 -78.486 -27.923 MODEL 13 POINT 1 69.885 -59.142 22.056 POINT 2 69.992 -57.968 23.033 MODEL 14 POINT 1 60.771 80.864 -67.242 POINT 2 60.765 82.035 -66.258 MODEL 15 POINT 1 88.367-100.303 26.657 POINT 2 88.485 -99.179 27.688 MODEL 16 POINT 1 71.362 19.714 75.498 POINT 2 71.461 20.908 76.450 MODEL 17 POINT 1 55.206 36.123 129.402 POINT 2 55.272 37.358 130.301 MODEL 18 POINT 1 -0.207 63.643 9.656 POINT 2 -0.119 64.869 10.566 MODEL 19 POINT 1 50.329 42.850 -53.654 POINT 2 50.424 44.067 -52.731 MODEL 20 POINT 1 51.532 -39.600 87.552 POINT 2 51.620 -38.437 88.540 MODEL 21 POINT 1 9.452 -38.136 23.088 POINT 2 9.459 -36.990 24.103 MODEL 22 POINT 1 52.844 16.158 -59.776 POINT 2 52.863 17.351 -58.818 MODEL 23 POINT 1 55.060 6.778 -32.793 POINT 2 55.121 7.966 -31.831 MODEL 24 POINT 1 63.527 -10.417 -15.482 POINT 2 63.570 -9.300 -14.436 MODEL 25 POINT 1 43.182 -28.794 21.016 POINT 2 43.233 -27.638 22.017 MODEL 26 POINT 1 93.739 -3.416 28.751 POINT 2 93.856 -2.334 29.826 MODEL 27 POINT 1 106.589 5.146 33.748 POINT 2 106.637 6.346 34.695 MODEL 28 POINT 1 51.597 -15.726 20.577 POINT 2 51.712 -14.540 21.538 MODEL 29 POINT 1 63.361 -27.745 -32.153 POINT 2 63.448 -26.576 -31.169 MODEL 30 POINT 1 -59.343 5.979 38.193 POINT 2 -59.203 7.083 39.244 MODEL 31 POINT 1 -4.120-119.412 -63.274 POINT 2 -4.040-118.211 -62.331 MODEL 32 POINT 1 38.468 -28.280 -19.797 POINT 2 38.602 -27.192 -18.729 MODEL 33 POINT 1 139.677-206.067 -84.072 POINT 2 139.702-204.924 -83.054 MODEL 34 POINT 1 35.819 -48.400 -10.080 POINT 2 35.876 -47.237 -9.088 | ||||||||||||
| NMRアンサンブル | 計算したコンフォーマーの数: 34 / 登録したコンフォーマーの数: 34 |
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj








































 X-PLOR
X-PLOR