+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3aqe | ||||||
|---|---|---|---|---|---|---|---|
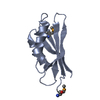
| タイトル | Crystal structure of the extracellular domain of human RAMP2 | ||||||
 要素 要素 | Receptor activity-modifying protein 2 | ||||||
 キーワード キーワード | TRANSPORT PROTEIN / Transmembrane / GPCR / Adrenomedullin / TRAFFICKING / CLR / CGRP / Endoplasmic Reticulum / DISEASE / Neovascularization / Helix bundle / Calcitonin Receptor-Like Receptor (CRLR) / Endoplasmic Reticulum (ER) / Cell membrane | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報basement membrane assembly / adrenomedullin binding / vascular associated smooth muscle cell development / adrenomedullin receptor activity / adrenomedullin receptor complex / adrenomedullin receptor signaling pathway / amylin receptor 2 signaling pathway / positive regulation of vasculogenesis / bicellular tight junction assembly / Calcitonin-like ligand receptors ...basement membrane assembly / adrenomedullin binding / vascular associated smooth muscle cell development / adrenomedullin receptor activity / adrenomedullin receptor complex / adrenomedullin receptor signaling pathway / amylin receptor 2 signaling pathway / positive regulation of vasculogenesis / bicellular tight junction assembly / Calcitonin-like ligand receptors / regulation of G protein-coupled receptor signaling pathway / negative regulation of vascular permeability / sprouting angiogenesis / adherens junction assembly / cellular response to vascular endothelial growth factor stimulus / negative regulation of endothelial cell apoptotic process / vasculogenesis / cellular response to hormone stimulus / coreceptor activity / clathrin-coated pit / protein localization to plasma membrane / intracellular protein transport / receptor internalization / regulation of blood pressure / adenylate cyclase-activating G protein-coupled receptor signaling pathway / positive regulation of angiogenesis / calcium ion transport / protein transport / heart development / High laminar flow shear stress activates signaling by PIEZO1 and PECAM1:CDH5:KDR in endothelial cells / angiogenesis / G alpha (s) signalling events / lysosome / receptor complex / G protein-coupled receptor signaling pathway / positive regulation of gene expression / cell surface / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 2 Å 多波長異常分散 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Kusano, S. / Kukimoto-Niino, M. / Shirouzu, M. / Shindo, T. / Yokoyama, S. | ||||||
 引用 引用 |  ジャーナル: Protein Sci. / 年: 2012 ジャーナル: Protein Sci. / 年: 2012タイトル: Structural basis for extracellular interactions between calcitonin receptor-like receptor and receptor activity-modifying protein 2 for adrenomedullin-specific binding 著者: Kusano, S. / Kukimoto-Niino, M. / Hino, N. / Ohsawa, N. / Okuda, K. / Sakamoto, K. / Shirouzu, M. / Shindo, T. / Yokoyama, S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3aqe.cif.gz 3aqe.cif.gz | 111.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3aqe.ent.gz pdb3aqe.ent.gz | 88.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3aqe.json.gz 3aqe.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3aqe_validation.pdf.gz 3aqe_validation.pdf.gz | 469.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3aqe_full_validation.pdf.gz 3aqe_full_validation.pdf.gz | 475.6 KB | 表示 | |
| XML形式データ |  3aqe_validation.xml.gz 3aqe_validation.xml.gz | 23.9 KB | 表示 | |
| CIF形式データ |  3aqe_validation.cif.gz 3aqe_validation.cif.gz | 32.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/aq/3aqe https://data.pdbj.org/pub/pdb/validation_reports/aq/3aqe ftp://data.pdbj.org/pub/pdb/validation_reports/aq/3aqe ftp://data.pdbj.org/pub/pdb/validation_reports/aq/3aqe | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 7 | 
| ||||||||
| 8 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 10581.471 Da / 分子数: 6 / 断片: extracellular Domain, UNP residues 56-139 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: RAMP2 / プラスミド: PX070809-03 / 発現宿主: Escherichia coli cell-free system / 参照: UniProt: O60895 Homo sapiens (ヒト) / 遺伝子: RAMP2 / プラスミド: PX070809-03 / 発現宿主: Escherichia coli cell-free system / 参照: UniProt: O60895#2: 水 | ChemComp-HOH / | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.94 Å3/Da / 溶媒含有率: 36.48 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 7.2 詳細: 0.1M Sodium-HEPES, 25% (v/v) PEG 400, 0.2M Calcium chloride di-hydrate, 0.15% Agarose , pH 7.2, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SPring-8 SPring-8  / ビームライン: BL26B2 / 波長: 0.9788, 0.9792, 0.9640 / ビームライン: BL26B2 / 波長: 0.9788, 0.9792, 0.9640 | ||||||||||||
| 検出器 | タイプ: RIGAKU JUPITER 210 / 検出器: CCD / 日付: 2008年6月6日 | ||||||||||||
| 放射 | モノクロメーター: Si double crystal / プロトコル: MAD / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||
| 放射波長 |
| ||||||||||||
| 反射 | 解像度: 2→50 Å / Num. obs: 33866 / % possible obs: 100 % / Observed criterion σ(I): -3 / 冗長度: 6.62 % / Rsym value: 0.084 / Net I/σ(I): 19.3 | ||||||||||||
| 反射 シェル | 解像度: 2→2.07 Å / Mean I/σ(I) obs: 7.7 / Rsym value: 0.24 / % possible all: 99.1 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  多波長異常分散 / 解像度: 2→36.408 Å / Occupancy max: 1 / Occupancy min: 1 / FOM work R set: 0.7331 / SU ML: 0.37 / Isotropic thermal model: RESTRAINED / σ(F): 1.33 / 位相誤差: 31.76 / 立体化学のターゲット値: ML 多波長異常分散 / 解像度: 2→36.408 Å / Occupancy max: 1 / Occupancy min: 1 / FOM work R set: 0.7331 / SU ML: 0.37 / Isotropic thermal model: RESTRAINED / σ(F): 1.33 / 位相誤差: 31.76 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.98 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL / Bsol: 35.941 Å2 / ksol: 0.376 e/Å3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 124.91 Å2 / Biso mean: 28.0343 Å2 / Biso min: 7.88 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→36.408 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 12
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj
