+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2xs3 | ||||||
|---|---|---|---|---|---|---|---|
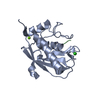
| タイトル | Structure of karilysin catalytic MMP domain | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | HYDROLASE / BACTERIAL MMP / VIRULENCE FACTOR / METALLOPROTEASE / ZINC-DEPENDENT / PEPTIDASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; その他のペプチターゼ / collagen catabolic process / extracellular matrix organization / extracellular matrix / metalloendopeptidase activity / proteolysis / extracellular region / zinc ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  TANNERELLA FORSYTHIA (バクテリア) TANNERELLA FORSYTHIA (バクテリア)SYNTHETIC CONSTRUCT (人工物) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.4 Å 分子置換 / 解像度: 2.4 Å | ||||||
 データ登録者 データ登録者 | Cerda-Costa, N. / Guevara, T. / Karim, A.Y. / Ksiazek, M. / Nguyen, K.-A. / Arolas, J.L. / Potempa, J. / Gomis-Ruth, F.X. | ||||||
 引用 引用 |  ジャーナル: Mol.Microbiol. / 年: 2011 ジャーナル: Mol.Microbiol. / 年: 2011タイトル: The Structure of the Catalytic Domain of Tannerella Forsythia Karilysin Reveals It is a Bacterial Xenologue of Animal Matrix Metalloproteinases. 著者: Cerda-Costa, N. / Guevara, T. / Karim, A.Y. / Ksiazek, M. / Nguyen, K.A. / Arolas, J.L. / Potempa, J. / Gomis-Ruth, F.X. #1: ジャーナル: Biol.Chem. / 年: 2010 タイトル: A Novel Matrix Metalloprotease-Like Enzyme (Karilysin) of the Periodontal Pathogen Tannerella Forsythia Atcc 43037. 著者: Karim, A.Y. / Kulczycka, M. / Kantyka, T. / Dubin, G. / Jabaiah, A. / Daugherty, P.S. / Thogersen, I.B. / Enghild, J.J. / Nguyen, K. / Potempa, J. #2: ジャーナル: J.Innate.Immun. / 年: 2010 タイトル: Proteolytic Inactivation of Ll-37 by Karilysin, a Novel Virulence Mechanism of Tannerella Forsythia. 著者: Koziel, J. / Karim, A.Y. / Przybyszewska, K. / Ksiazek, M. / Rapala-Kozik, M. / Nguyen, K. / Potempa, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2xs3.cif.gz 2xs3.cif.gz | 155.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2xs3.ent.gz pdb2xs3.ent.gz | 122.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2xs3.json.gz 2xs3.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2xs3_validation.pdf.gz 2xs3_validation.pdf.gz | 452.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2xs3_full_validation.pdf.gz 2xs3_full_validation.pdf.gz | 455.4 KB | 表示 | |
| XML形式データ |  2xs3_validation.xml.gz 2xs3_validation.xml.gz | 15.8 KB | 表示 | |
| CIF形式データ |  2xs3_validation.cif.gz 2xs3_validation.cif.gz | 21.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/xs/2xs3 https://data.pdbj.org/pub/pdb/validation_reports/xs/2xs3 ftp://data.pdbj.org/pub/pdb/validation_reports/xs/2xs3 ftp://data.pdbj.org/pub/pdb/validation_reports/xs/2xs3 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 18703.615 Da / 分子数: 2 / 断片: RESIDUES 35-200 / 由来タイプ: 組換発現 由来: (組換発現)  TANNERELLA FORSYTHIA (バクテリア) TANNERELLA FORSYTHIA (バクテリア)発現宿主:  #2: タンパク質・ペプチド | 分子量: 424.448 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然) SYNTHETIC CONSTRUCT (人工物) #3: 化合物 | ChemComp-ZN / #4: 化合物 | ChemComp-TRS / | #5: 水 | ChemComp-HOH / | 非ポリマーの詳細 | ZINC CATION (ZN): CATALYTIC 999 AND STRUCTURAL | 配列の詳細 | ONLY THE CATALYTIC DOMAIN (TYR35-PHE200) WAS CRYSTALLIZED. A PEPTIDE WAS FOUND AT THE ACTIVE SITE ...ONLY THE CATALYTIC DOMAIN (TYR35-PHE200) WAS CRYSTALLIZ | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.54 Å3/Da / 溶媒含有率: 51.51 % / 解説: NONE |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 詳細: CRYSTALLIZATION ASSAYS WERE PERFORMED BY THE SITTING-DROP VAPOR DIFFUSION METHOD. RESERVOIR SOLUTIONS WERE PREPARED BY A TECAN ROBOT AND CRYSTALLIZATION DROPS WERE DISPENSED ON 96X2-WELL MRC ...詳細: CRYSTALLIZATION ASSAYS WERE PERFORMED BY THE SITTING-DROP VAPOR DIFFUSION METHOD. RESERVOIR SOLUTIONS WERE PREPARED BY A TECAN ROBOT AND CRYSTALLIZATION DROPS WERE DISPENSED ON 96X2-WELL MRC PLATES (INNOVADYNE) BY A CARTESIAN (GENOMIC SOLUTIONS) NANODROP ROBOT AT THE HIGH-THROUGHPUT CRYSTALLOGRAPHY PLATFORM AT BARCELONA SCIENCE PARK. CRYSTALS SUITABLE FOR STRUCTURE ANALYSIS WERE OBTAINED FOR UNBOUND KLY18 IN A BRUKER STEADY-TEMPERATURE CRYSTAL FARM AT 20C FROM DROPS CONTAINING 100NL OF PROTEIN SOLUTION (AT 9MG ML-1 IN 5MM TRIS-HCL, PH8.0, 0.02% SODIUM AZIDE) AND 100NL OF 45% 2-METHYL-2,4-PENTANEDIOL, 0.2M AMMONIUM ACETATE, 0.1M TRIS-HCL, PH8.5 AS RESERVOIR SOLUTION. |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-2 / 波長: 0.8726 / ビームライン: ID23-2 / 波長: 0.8726 |
| 検出器 | タイプ: MARRESEARCH / 検出器: CCD |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.8726 Å / 相対比: 1 |
| 反射 | 解像度: 2.4→45.3 Å / Num. obs: 15411 / % possible obs: 99.3 % / Observed criterion σ(I): 0 / 冗長度: 4.1 % / Biso Wilson estimate: 38.4 Å2 / Rmerge(I) obs: 0.09 / Net I/σ(I): 14.8 |
| 反射 シェル | 解像度: 2.4→2.53 Å / 冗長度: 3.4 % / Rmerge(I) obs: 0.51 / Mean I/σ(I) obs: 2.5 / % possible all: 95.9 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1MNC 解像度: 2.4→50 Å / Cor.coef. Fo:Fc: 0.943 / Cor.coef. Fo:Fc free: 0.897 / SU B: 17.868 / SU ML: 0.203 / 交差検証法: THROUGHOUT / ESU R: 0.422 / ESU R Free: 0.277 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: BABINET MODEL WITH MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 33.731 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.4→50 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj






